
【题目】CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___(填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___kJ·mol-1。
③反应(II)的△S___(填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___(填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
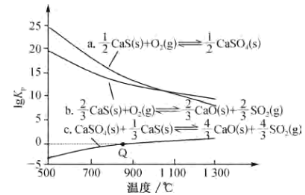
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___。
③反应c在Q点时:p(SO2)=___kPa,以浓度表示的平衡常数Kc=___Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
【答案】不变 +601.4 > BD c 2lgKp(b)-2lgKp(a) 1 (RT)![]()
【解析】
(1)①若在恒温恒容密闭容器中只发生反应(I),平衡常数K=c2(CO2),温度不变平衡常数不变;
②根据盖斯定律计算解答;
③反应(II) CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应;
CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应;
A.v(H2O)正=v(CO2)正都是正反应方向的速率;
B.在恒温恒容条件下,反应(II)为气体体积增大的反应;
C.不论反应是否到平衡,反应一开始,容器中同时存在H2S(g)、CO2(g)和H2O(g);
D.单位时间内断裂H-S键与断裂C=O键数目相等,说明正逆反应速率相等;
(2)①lgKp越小,平衡常数越小,根据图像,升高温度,lgK减小,平衡常数减小,据此分析解答;
②a:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaSO4(s) Kp(a)
CaSO4(s) Kp(a)
b:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(b)
SO2(g) Kp(b)
c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(c)
SO2(g) Kp(c)
根据盖斯定律c=2(b-a)可得,Kp(c)=(![]() )2;
)2;
③反应c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1;以浓度表示的平衡常数Kc=
SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1;以浓度表示的平衡常数Kc=![]() ,根据pV=nRT,
,根据pV=nRT,![]() =c,据此分析解答。
=c,据此分析解答。
(1)①若在恒温恒容密闭容器中只发生反应(I),平衡常数K=c2(CO2),温度不变平衡常数不变,则反应再次达到平衡时c(CO2)将不变;
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
根据盖斯定律,i+ii+iii ×2可得:CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1=+601.4 kJ·mol-1;
CaS(s)+2CO2(g) △H1=+601.4 kJ·mol-1;
③反应(II) CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应体系,体系的混乱度增大,则△S>0;
CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应体系,体系的混乱度增大,则△S>0;
A.v(H2O)正=v(CO2)正都是正反应方向的速率,不能作为判断反应达到平衡的依据,故A不符合题意;
B.恒温恒容条件下,反应(II)为气体体积增大的反应体系,当容器中气体总压强不再随时间变化时,反应达到平衡状态,故B符合题意;
C.不论反应是否达到平衡状态,只要反应一开始,容器中就同时存在H2S(g)、CO2(g)和H2O(g),不能作为判断反应达到平衡状态的标志,故C不符合题意;
D.单位时间内断裂H-S键与断裂C=O键数目相等,即消耗1mol H2S的同时也消耗1mol的CO2,即正逆反应速率相等,可说明反应达到平衡状态,故D符合题意;
答案选BD。
(2)①根据图像,随温度升高反应a、b 的lgKp减小,平衡常数减小,说明反应逆向移动,则正反应为放热反应;随温度升高反应c的lgKp增大,平衡常数增大,说明反应正向移动,则正反应为吸热反应;
②a:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaSO4(s) Kp(a)
CaSO4(s) Kp(a)
b:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(b)
SO2(g) Kp(b)
c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(c)
SO2(g) Kp(c)
根据盖斯定律c=2(b-a)可得,Kp(c)=(![]() )2;
)2;
则lgKp(c)=2lg (![]() )=2lgKp(b)-2lgKp(a);
)=2lgKp(b)-2lgKp(a);
③反应c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1=
SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1=![]() ,则p(SO2)=1kPa;以浓度表示该反应的平衡常数Kc=
,则p(SO2)=1kPa;以浓度表示该反应的平衡常数Kc=![]() ,根据pV=nRT,
,根据pV=nRT,![]() =c,则c(SO2)=
=c,则c(SO2)=![]() ,则Kc=
,则Kc=![]() =
=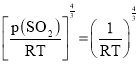 =(RT)
=(RT)![]() ,则
,则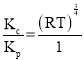 ,Kc=(RT)
,Kc=(RT)![]() Kp。
Kp。


科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是___。
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0molL-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将___(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:
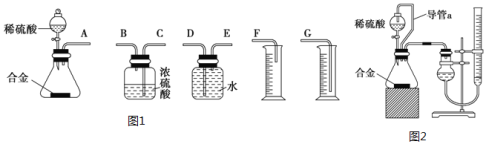
你认为最简易的装置其连接顺序是A接___接___接___(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①装置中导管a的作用是___。
②实验前后碱式滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0.1mol·L-1的Na2CO3溶液中,阴离子总数一定大于0.1NA
B.常温常压下,由32gO2与O3组成的混合气体中含有的分子总数小于NA
C.36.0gCaO2与足量水完全反应,转移的电子数为NA
D.1molCH4与1molCl2混合,充分反应后,生成气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法不能达到实验目的的是
A.加热除去食盐中少量的NH4Cl固体
B.用饱和NaHCO3溶液除去CO2中的SO2
C.用稀盐酸除去铜粉中少量的铁粉
D.用BaCl2溶液除去NaCl溶液中的K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
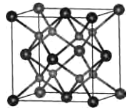
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为同学们使用的一种碳素墨水笔,在组成这种墨水笔的各种材料中:
![]()
(1)属于有机高分子材料的是(选填一种即可)________。
(2)属于金属材料的是(填元素符号)________,______。
(3)目前世界上对废金属材料已得到回收利用,这样做的意义是______。
(4)碳素墨水是________(填“混合物”或“纯净物”)。
(5)写出其中的金属材料与硫酸铜溶液反应的一个化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中设计两个关于NO的探究实验。
(一)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,探究NO和NH3能否反应。
(1)氨气的制备

①氨气的发生装置可以选择上图中的_____,反应的化学方程式______________________
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→__________(按气流方向,用小写字母表示)。
(2)将上述收集到的NH3加入少量催化剂,充入NO,充分混合,冷却到室温,观察到管中有少量水珠,说明NO和NH3能反应,则氧化剂和还原剂的物质的量之比为__________。
(二)探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3 -。
回答下列问题:
(1)仪器a名称:________________ 。
(2)B瓶内装的物质是:_______________ 。
(3)若NO能被Na2O2完全吸收,E装置中的现象为 ______________ 。
(4)三颈烧瓶A中反应的化学方程式为____________________________。
(5)C装置的作用是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com