
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
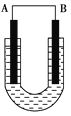
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
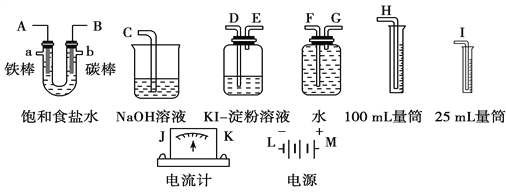
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
【答案】 正 铜 O2+2H2O+4e-===4OH- 2Fe+O2+2H2O===2Fe(OH)2 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ H,F,G,A,B,D,E,C Cl2+2I-===2Cl-+I2
【解析】(1)①正极附近生成氢氧根离子,酚酞遇碱变红色,在A极观察到酚酞变红,说明A为正极,则A为金属铜;故答案为:正;铜;
②该原电池中,Fe易失电子发生氧化反应而作负极,电极反应式为:Fe-2e-=Fe2+,Cu作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=40H-,正极附近生成氢氧根离子,两电极反应式相加即为总反应2Fe+O2+2H2O═2Fe(OH)2,故答案为:O2+2H2O+4e-═4OH-;2Fe+O2+2H2O═2Fe(OH)2;
(2)①A是阴极、B是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,所以阴极、阳极电极反应式分别为2H++2e-=H2↑、2Cl--2e-=Cl2↑,故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
②电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,相应装置的作用:![]() 所以其连接顺序是:H←F←G←A,B→D→E→C,故答案为:H,F,G,A,B,D,E,C;
所以其连接顺序是:H←F←G←A,B→D→E→C,故答案为:H,F,G,A,B,D,E,C;
③氯气和碘离子发生置换反应生成碘和氯离子,离子方程式为Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-。


科目:高中化学 来源: 题型:
【题目】关于离子键、共价键等化学键的下列叙述中正确的( )
A.在单质中一定不存在离子键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在离子化合物里,只存在离子键,没有共价键
D.化学键断裂一定伴随着化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 的分子式均为C8H8,下列说法正确的是( )
(z) 的分子式均为C8H8,下列说法正确的是( )
A. x完全氢化后的产物为q,q的一氯代物有六种同分异构体
B. x、y、z中的所有原子不可能都处于同一平面上
C. 可以用y萃取溴水中的溴
D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是
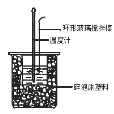
A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol金属钠与氧气完全反应,转移的电子数一定为NA
B. 25℃时,pH=1盐酸溶液中含有H+的数目约为0.1NA
C. 任意条件下,1mol苯中含C-C键的数目一定为3NA
D. 密闭容器中充入1molNO2,气体分子数一定是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+ B(g)![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = _________________
(2)从反应开始到10s,B的平均反应速率为______________
(3)平衡时容器中B的体积分数为___________________
(4)该温度下此反应的平衡常数表达式为_______________
(5)下列各项能表示该反应达到平衡状态是_____________
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) = 2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下到有关电解质溶液的说法不正确的是( )
A. 向Na2CO3溶液中通入NH3, 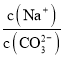 减小
减小
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,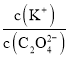 增大
增大
C. 向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性, 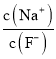 =1
=1
D. 向0.1mol·L-1的CH3COONa溶液中加入少量水, 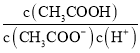 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A. v(A)=0.5molL﹣1.mim﹣1
B. v(B)=0.3molL﹣1.mim﹣1
C. v(C)=0.8molL﹣1.mim﹣1
D. v(D)=1.0molL﹣1.mim﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com