
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
分析 A.醋酸是弱电解质,加水稀释促进醋酸电离;
B.用蒸馏水润湿的试纸测溶液的pH,导致溶液浓度偏低,但测定结果不一定有误差;
C.醋酸钠是强碱弱酸盐,其水溶液呈酸性,要使混合溶液呈中性,则醋酸应该稍微过量;
D.100℃时,pH=2的盐酸溶液中c(H+)为0.01mol/L、pH=12的NaOH溶液中c(OH-)大于0.01mol/L,二者等体积混合NaOH过量.
解答 解:A.醋酸是弱电解质,加水稀释促进醋酸电离,则常温下将pH=3的醋酸溶液稀释到原体积的10倍后,氢离子浓度大于原来的$\frac{1}{10}$,所以稀释后溶液的pH<4,故A错误;
B.用蒸馏水润湿的试纸测溶液的pH,导致溶液浓度偏低,但测定结果不一定有误差,如强酸强碱盐pH值与溶液浓度无关,故B错误;
C.醋酸钠是强碱弱酸盐,其水溶液呈酸性,要使混合溶液呈中性,则醋酸应该稍微过量,则25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH,故C正确;
D.100℃时,pH=2的盐酸溶液中c(H+)为0.01mol/L、pH=12的NaOH溶液中c(OH-)大于0.01mol/L,二者等体积混合NaOH过量,所以混合溶液呈碱性,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断、弱电解质的电离、溶液pH值的测定等知识点,为高频考点,侧重考查学生分析判断能力,明确弱电解质电离特点、离子积常数与温度关系是解本题关键,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
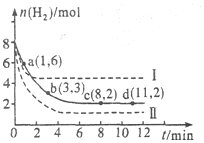 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
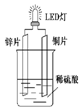 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 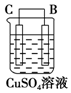 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉-KI试液 | 先变蓝后褪色 | Cl2具有氧化性和漂白性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224mL | D. | 672mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com