
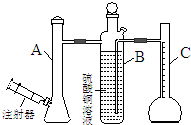
| A. | 反应前后抽气使B中导管内外液面持平 | |
| B. | 用饱和食盐水代替A装置中的蒸馏水 | |
| C. | 把A装置浸入盛有冰水混合物的水槽中 | |
| D. | 在B装置中的硫酸铜溶液表面覆盖一层苯 |
分析 A.气体测量应在相同压强下;
B.饱和食盐水代替蒸馏水,可以减缓反应速率;
C.降低溶液的温度可以减缓反应速率;
D.硫酸铜溶液表面覆盖一层苯,容易导致装置内外的压强不等.
解答 解:A.反应前后抽气使B中导管内外液面持平,可以使测量的气体体积更准确,故A正确;
B.用饱和食盐水代替A装置中的蒸馏水,可以减缓反应速率,故B正确;
C.把A装置浸入盛有冰水混合物的水槽中,可以降低溶液的温度,减缓反应速率,故C正确;
D.在B装置中的硫酸铜溶液表面覆盖一层苯,容易导致装置内外的压强不等,使测量的气体体积不准确,故D错误.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解 | |
| C. | 乙烯水化成乙醇,原子利用率为百分之百,符合绿色化学原理 | |
| D. | 淀粉与纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
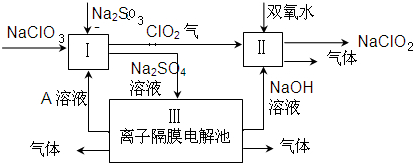
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
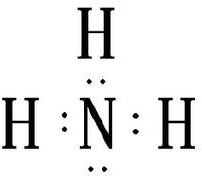 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可作耐磨材料 | |
| B. | 它不可用作致冷剂 | |
| C. | 晶体中每个碳原子形成2个碳氧双键 | |
| D. | 晶体中碳、氧原子个数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
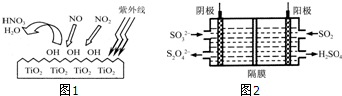
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
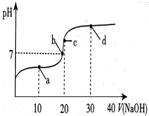 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 | |
| B. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com