
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:

已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是

A.在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、烧杯、玻璃棒
B.在上述氧化过程中发生的离子方程式为:2I-+H2O2 = I2 + 2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D.次氯酸钠可以与亚硫酸钠共存
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
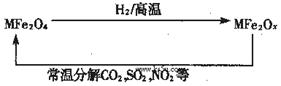
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A.常温下,1mol丙烯中含碳原子数为3NA
B.常温下,pH=13的 NaOH溶液中含OH-数为NA
C.标准状况下,22.4LCHCl3中含C-H键数为NA
D.23g Na与足量氧气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O俗称“海波”,是常用的脱氯剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2S O3+S
O3+S Na
Na 2S2O3
2S2O3
制备海波的流程:

(1)实验开始时 用1 mL乙
用1 mL乙 醇润湿硫粉的作用是 。
醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是  。
。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液
C. 水 D.滤液
水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol·L-1的标准碘水 溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
8化学与社会、生活、生产密切相关。对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com