
| A、标准状况下,22.4L己烷中碳碳共价键数目为5NA | B、0.1mol?L-1的AlCl3溶液中含有的氯离子数为0.3NA | C、0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.2NA | D、10mL 5mol/L (NH4)2S04溶液中含有NH4+数目为0.1NA |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、由CO2和O2组成的混合物中共有NA个分子,其中所含氧原子的物质的量为2mol | B、5.6gFe在0.1molCl2中充分燃烧,失去的电子数为0.3NA | C、常温常压下,100g17%H2O2水溶液中含有的氧原子总数为NA | D、标准状况下,22.4LNO与11.2LO2混合,充分反应后NO2的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某温度下,1 L pH=8的纯水中含OH-为10-8NA | B、14 g分子通式为CnH2n的链烃中含有的C=C键数目为NA | C、标准状况下,22.4 L Cl2与足量Fe反应,转移的电子数为3NA | D、常温下,1 L 0.1 mol?L-1 CH3COONa溶液中含有的Na+和CH3COO-总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用盐析法分离NaCl溶液和淀粉胶体 | B、天然油脂的分子中含有酯基,属于酯类 | C、T℃时,1L pH=6的纯水中,含有的OH-数目为l×10-6NA | D、12.0 gNaHSO4固体中含有的阳离子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和丙烯组成的混合气体28g中含有3NA个氢原子 | B、22.4L氢气和4g氦气均含有NA个分子 | C、23g的钠与氧气完全反应,转移的电子数一定是NA | D、标准状况下,2.24LCl2与稀NaOH溶液反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g CO和16g O2所含的氧原子数都为NA | B、100mL 0.1 mol?L-1 AlCl3溶液中Al3+总数为0.01NA | C、标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | D、5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的KAl(SO4)2溶液中,硫酸根离子数为0.2 NA | B、2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | C、5.6 g铁和1 mol铝一起溶于稀硫酸中,失去电子数为0.6 NA | D、在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、剩余固体是铁、铜混合物 | B、原固体混合物中铜的质量是12.4g | C、反应后溶液中n(Fe3+)=0.10 mol | D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| ①取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| ②过滤,测漂粉精溶液的pH | pH试纸先变蓝,最后褪色 |
③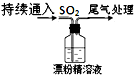 |
液面上方出现白雾;稍后,出现浑浊,溶液变为黄绿色;最终,产生大量白色沉淀,黄绿色褪去. |
| A、Cl2和Ca(OH)2制取漂粉精的化学方程式是:2Cl2+2Ca(OH)2→CaCl2+Ca(ClO)2+2H2O |
| B、pH试纸颜色的变化说明漂粉精溶液具有碱性、漂白性 |
| C、液面上方出现白雾,白雾中一定只含HCl |
| D、最后,产生大量白色沉淀,黄绿色褪去,推测白色沉淀主要是CaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com