
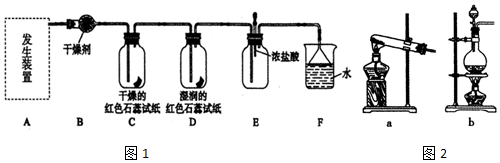
分析 (1)根据反应物状态和条件选择;
(2)氨气为碱性气体,选择碱性干燥剂;
(3)根据氯化铵和氨气的关系式计算氨气的体积;
(4)氨气与干燥的红色石蕊试纸不变色,氨气能使湿润的红色石蕊试纸变蓝;
(5)氨气与挥发的HCl会生成白烟氯化铵固体;
(6)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置;
(7)无色酚酞试液遇碱变红色,极易溶于水的气体能形成喷泉;
(8)根据化合价升高被氧化表现还原性,化合价降低被还原表现氧化性分析,氨气可用作 ①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料等.
解答 解:(1)用氯化铵和氢氧化钙在加热的条件下制备氨气,为固固加热型,选择a装置;
故答案为:a;
(2)氨气为碱性气体,选择碱性干燥剂碱石灰;
故答案为:碱石灰;
(3)n(NH4Cl)=$\frac{5.35g}{53.5g/mol}$=0.1mol,根据反应方程式可知,n(NH3)=n(NH4Cl)=0.1mol,所以V(NH3)=n•Vm=0.1mol×22.4L/mol=2.24L;
故答案为:2.24;
(4)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化;
故答案为:D;
(5)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产;
故答案为:有白烟生成;
(6)因为氨气极易溶于水,所以F中吸收氨气时用倒扣漏斗来防倒吸;
故答案为:防止倒吸;
(7)无色酚酞遇碱变红色,观察到美丽的红色喷泉,则氨气的水溶液呈碱性,氨气极易溶于水而形成压强差,导致形成喷泉;
故答案为:bc;
(8)用氨气处理二氧化氮:8NH3+6NO2═7N2+12H2O,该反应中,氨气中的氮元素化合价从-3价升高到0价,被氧化,表现还原性;氨气可用作 ①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料
等;
故答案为:还原性; ①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料.
点评 本题考查了氨气的制备及氨气的性质,题目难度中等,明确实验原理是解本题关键,根据氨气的溶解性及密度确定收集方法,知道形成喷泉的条件:只要气体极易溶于该溶液就能形成喷泉,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:推断题
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含Ag+ | B. | 一定含SO42- | C. | 含有Ag+或SO42- | D. | 含有Ag+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,5,6 | B. | 3,4,5,6 | C. | 2,3,4,5 | D. | 4,5,6,7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | 收集氯气用排饱和食盐水的方法 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解硫酸或酸式硫酸盐溶液,阳极反应为2SO42--2e-═S2O82- | |
| B. | S2O82-具有强氧化性,H2S2O8是二元强酸 | |
| C. | 减压蒸馏的目的是为了减少H2O2分解,蒸馏得到的另一组分可循环利用 | |
| D. | 由溶液A转化为溶液B发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | H2SO4 | C. | H2O | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com