
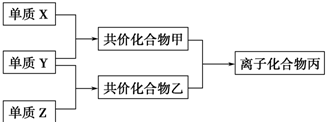
 ;
;分析 常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,以此解答该题.
解答 解:常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,
(1)X为N2,分子中含有3个共价键,结构式为N≡N,故答案为:N≡N;
(2)化合物甲为NH3,为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
(3)化合物丙为NH4Cl,为离子化合物,含有离子键和共价键,故答案为:离子键、共价键.
点评 本题考查无机物的推断,题目难度不大,注意把握题中信息,认真审题,为解答该题的关键,学习中注重相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
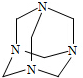 乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述弱酸溶液的 pH=4 | |
| B. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH=7 | |
| C. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH>7 | |
| D. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A=1×10-4B | B. | B=1×10-4A | C. | A>B | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 235g核素92235U发生裂变反应:92235U+01n$\stackrel{裂变}{→}$3890Sr+54136Xe+1001n净产生的中子(01n)数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com