
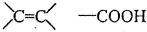 ;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂).
;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂). .
. (CH3)2CHCOOCH2CH3+H2O.
(CH3)2CHCOOCH2CH3+H2O.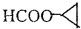 .
.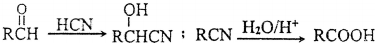
 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
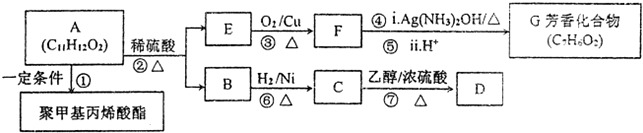
分析 A发生水解反应反应得到E、B,E连续氧化得到芳香族化合物G,结合G的分子式可知,E为 ,F为
,F为 ,G为
,G为 .A可以得到聚甲基丙烯酸酯,结合A的分子式可知A为
.A可以得到聚甲基丙烯酸酯,结合A的分子式可知A为 ,则A在酸催化作用下水解生成B为
,则A在酸催化作用下水解生成B为 ,B和氢气加成生成C为
,B和氢气加成生成C为 ,C和乙醇反应生成D为
,C和乙醇反应生成D为 .
.
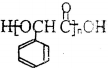
(6)甲苯与氯气在光照条件下得到 ,在氢氧化钠水溶液、加热条件下水解生成苯甲醇,催化氧化生成苯甲醛,与HCN发生加成反应得到
,在氢氧化钠水溶液、加热条件下水解生成苯甲醇,催化氧化生成苯甲醛,与HCN发生加成反应得到 ,酸性条件下水解生成
,酸性条件下水解生成 ,最后发生缩聚反应生成
,最后发生缩聚反应生成 .
.
解答 解:A发生水解反应反应得到E、B,E连续氧化得到芳香族化合物G,结合G的分子式可知,E为 ,F为
,F为 ,G为
,G为 .A可以得到聚甲基丙烯酸酯,结合A的分子式可知A为
.A可以得到聚甲基丙烯酸酯,结合A的分子式可知A为 ,则A在酸催化作用下水解生成B为
,则A在酸催化作用下水解生成B为 ,B和氢气加成生成C为
,B和氢气加成生成C为 ,C和乙醇反应生成D为
,C和乙醇反应生成D为 .
.
(1)反应①是A发生加聚反应,反应②发生酯的水解反应,也属于取代反应,
故答案为:加聚反应;水解反应或取代反应;
(2)B为 ,B所含官能团的结构简式:
,B所含官能团的结构简式: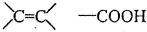 ,用溴的四氯化碳(或酸性高锰酸钾溶液)检验碳碳双键,用碳酸氢钠溶液(或石蕊试剂)检验羧基,
,用溴的四氯化碳(或酸性高锰酸钾溶液)检验碳碳双键,用碳酸氢钠溶液(或石蕊试剂)检验羧基,
故答案为: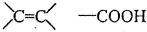 ;溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂);
;溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂);
(3)H是C( )的同系物,比C的相对分子质量大14,比C多1个CH2原子团,其核磁共振氢谱仅有2个吸收峰,H的结构简式为:CH3C(CH3)2COOH,名称(系统命名)为:2,2一二甲基丙酸,
)的同系物,比C的相对分子质量大14,比C多1个CH2原子团,其核磁共振氢谱仅有2个吸收峰,H的结构简式为:CH3C(CH3)2COOH,名称(系统命名)为:2,2一二甲基丙酸,
故答案为:2,2一二甲基丙酸;
(4)反应④的化学方程式为: ,
,
反应⑦的化学方程式为:(CH3)2CHCOOH+CH3CH2OH (CH3)2CHCOOCH2CH3+H2O,
(CH3)2CHCOOCH2CH3+H2O,
故答案为: ;
;
(CH3)2CHCOOH+CH3CH2OH (CH3)2CHCOOCH2CH3+H2O;
(CH3)2CHCOOCH2CH3+H2O;
(5)B( )的同分异构体符合:①能与NaOH水溶液反应,②能发生银镜反应,含有甲酸形成的酯基,③核磁共振氢谱有三组吸收峰,且峰面积之比为1:1:4,符合条件的同分异构体为:,
)的同分异构体符合:①能与NaOH水溶液反应,②能发生银镜反应,含有甲酸形成的酯基,③核磁共振氢谱有三组吸收峰,且峰面积之比为1:1:4,符合条件的同分异构体为:,
故答案为: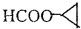 ;
;
(6)甲苯与氯气在光照条件下得到 ,在氢氧化钠水溶液、加热条件下水解生成苯甲醇,催化氧化生成苯甲醛,与HCN发生加成反应得到
,在氢氧化钠水溶液、加热条件下水解生成苯甲醇,催化氧化生成苯甲醛,与HCN发生加成反应得到 ,酸性条件下水解生成
,酸性条件下水解生成 ,最后发生缩聚反应生成
,最后发生缩聚反应生成 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用有机物的分子式、结构特点与反应条件进行推断,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铝、二氧化硫 | ||
| C. | 液态的醋酸、酒精 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 5:7 | D. | 7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol/(L•s) | B. | 2.0mol/(L•s) | C. | 4.0mol/(L•s) | D. | 6.0mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
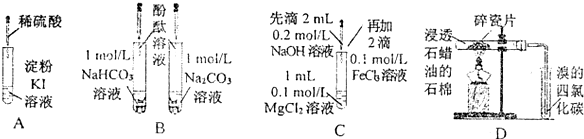
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中H+的个数增大 | D. | Kw的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
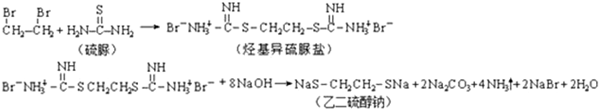

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com