
分析 (1)根据硅原子电子排布式:1s22s22p63s23p2确定能级,根据洪特确定自旋方向;SiO2晶体中每个硅原子与4个氧原子形成4个Si-O共价键;
(2)非金属性越强,单质的氧化性越强;减少生成物的浓度,平衡正向移动;
(3)四氯化硅是正四面体结构,分子结构对称的是非极性分子;
(4)体积减小,压强增大,平衡正向移动,氯气的物质的量减小,但体积减小更大,浓度增大;
(5)根据v=$\frac{△C}{△t}$来求出氯气的速率,再根据速率之比等于化学计量数之比来解答;
(6)降低压强向体积增大的方向移动,升高温度向吸热方向移动,减少生成物的浓度,平衡正向移动.
解答 解:(1)硅原子电子排布式:1s22s22p63s23p2,核外有5种不同能级的电子,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先占据不同轨道,而且自旋方向相同,最外层的p电子有1种自旋方向;SiO2晶体中每个硅原子与4个氧原子形成4个Si-O共价键;
故答案为:5;1;4;
(2)非金属性越强单质的氧化性越强,碳的还原性弱于硅;减少生成物CO的浓度,平衡正向移动;
故答案为:弱于;因为生成物CO为气态,降低CO的浓度,可使平衡正向移动;
(3)四氯化硅是正四面体结构,SiCl4分子结构对称结构,属于非极性分子;
故答案为:正四面体型;非极性;
(4)体积减小,压强增大,平衡正向移动,氯气的物质的量减小,但体积减小更大,浓度增大;
故答案为:小于;
(5)氯气的反应速率v(Cl2)=$\frac{△C}{△t}$=$\frac{2a-b}{t}$mol/(L•s),v(SiCl4)=$\frac{1}{2}$v(Cl2)=$\frac{2a-b}{2t}$mol/(L•s);
故答案为:$\frac{2a-b}{2t}$mol/(L•s);
(6)降低压强;升高温度;及时分离出HCl使平衡正向移动;
故答案为:降低压强;升高温度(或及时分离出HCl等).
点评 本题涉及知识点较多,考查原子结构、还原性比较、电子式和平衡移动、化学反应速率等,难度中等,注意掌握平衡移动原理是解题的关键.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )的合成路线如下:
)的合成路线如下: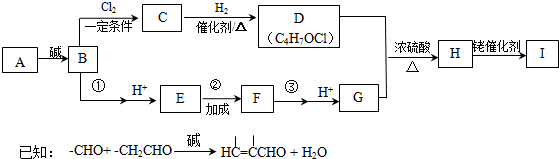
 ,B→C的反应类型为取代反应.
,B→C的反应类型为取代反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| B. | 加入合适的催化剂,可增加单位质量的硫燃烧放出的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q1 kJ;Q1的值大于297.23 | |
| D. | 足量的硫粉与标况下1升氧气反应生成1升二氧化硫气体时放出297.23 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只闭合K2,该装置将电能转化为化学能 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐升高 | |
| C. | 只闭合K2,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | 铁腐蚀的速度由大到小的顺序是:只闭合K1>都断开>只闭合K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.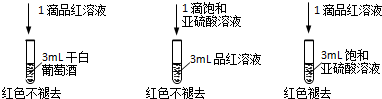
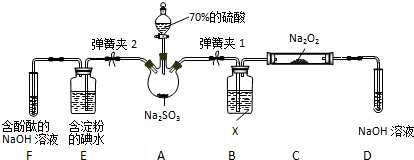
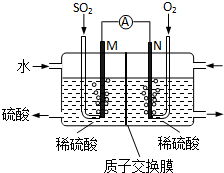
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com