
| A、IA族 | B、ⅡA族 |
| C、ⅢA族 | D、IVA族 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、一定不存在Ba2+,NH4+可能存在 |
| B、CO32- 一定存在 |
| C、Na+一定不存在 |
| D、一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜的硫化物具有氧化性 |
| B、CuS的溶解度大于ZnS的溶解度 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、以上过程涉及到了氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A、根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
| C、到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的原子半径大于Y的原子半径 |
| B、X的电负性小于Y的电负性 |
| C、X的阴离子半径大于Y的阳离子半径 |
| D、X的I1小于Y 的I1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、1-丁醇和乙酸能反应完或者有一种能消耗完 |
| D、为了提高反应速率,所以要加入浓硫酸做催化剂并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
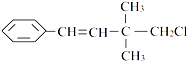 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com