(2013?安徽模拟)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.
甲同学根据已学知识,提出了一套回收方案:

乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H
2SO
4+O
22CuSO
4+2H
2O),于是他提出了另一套方案:

(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①
; ③
Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
.
(2)从环保角度对两套方案的不同部分进行比较,你认为
乙
乙
(填“甲”或“乙”)的方案更合理.理由是:
甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾
.
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是:
将Cu完全置换出来
将Cu完全置换出来
.
丁又提出了疑问:“如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?”.
请提出你的想法:
所得铜粉酸洗后再洗涤、干燥
所得铜粉酸洗后再洗涤、干燥
.
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.如果直接排放掉滤液,不仅造成了浪费,还会
造成水污染或环境污染
造成水污染或环境污染
.
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸
4900
4900
g,需水
3060
3060
mL(水的密度为1.0g/mL),在实验室中稀释浓硫酸时,是如何操作的:
将浓硫酸沿烧杯内壁缓缓加入水中,边加边搅拌
将浓硫酸沿烧杯内壁缓缓加入水中,边加边搅拌
.

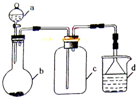 (2013?安徽)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
(2013?安徽)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案