
 以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.
以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.| m |
| ρ |
| 3 | V晶胞 |
| 1 |
| 4 |
| 40 |
| NA |
| 40 |
| NA |
| 3 | V晶胞 |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、电解氯化镁溶液:2Cl-+2H2O
| ||||
| B、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO | ||||
| C、将少量CO2气体通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | ||||
| D、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| NaOH溶液 |
| CH3COOH |
| 浓硫酸,△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
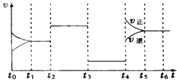 (1)已知下列反应:
(1)已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | a | b |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、平衡时,X的转化率为20% |
| B、t℃时,该反应的平衡常数为1600 |
| C、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
| D、前2min内,用Y变化量表示的平均反应速率v(Y)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合质子能力比CO32-强 |
| B、向少量的稀溴水中滴入饱和苯酚溶液立即产生白色沉淀 |
| C、检验废铁屑溶于盐酸后所得的溶液中是否含有Fe2+,可向其中加入酸性KMnO4溶液,根据其是否褪色进行判断 |
| D、加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 有机物 | 水杨酸 | 冬青油 | 阿司匹林 |
| 结构简式 |  |  |  |
 )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com