
����Ŀ���������ȣ�ClO2����һ�����������������������ƣ�NaClO3��Ϊԭ���Ʊ���
��1����Ĥ��ⷨ�Ʊ�ClO2��װ��ʾ��ͼ���£�
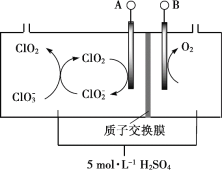
��֪��ClO2��������Һ�бȽ��ȶ����ڼ�����Һ�в����ȶ����ڡ�
�ٲ���O2�ĵ缫��Ӧʽ��________��
�ڽ�Ϸ�Ӧ����ʽ������ClO2�IJ������̣�_________��
��2���������ԭ���Ʊ�ClO2��![]() �о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
�о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
����NaCl ��Ũ��/(g��L1) | ClO2����������/(g��L-1��min-1) | ��ͬʱ�� | |||
10 min | 30 min | 60 min | ClO2 ����/% | Cl2 ���� | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | ���� |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | ���� |
��NaCl����Ҫ������_______��
��������Ӧ���ܵĹ������£�
��Ӧi��![]() +
+ ![]() + +
+ +
��Ӧii�� Cl2 + H2O2 = 2Cl- + O2�� + 2H+
����Ӧi��д����_________��
�۽�һ���о����֣�δ����Cl-ʱ����ϵ�����Ȼᷢ����Ӧ����Cl-����ӦΪ��ClO3- + 3H2O2 = Cl- + 3O2��+3H2O����Ӧiii����������Ӧi��ii��iii�����ʴ�С��ϵ����Ҫ˵�����ɣ�_________��
��3�����ҹ涨������ˮ��ClO2�IJ��������ø���0.8 mg��L-1����ⲽ�����£�
����ȡ1.0L������ˮ������������ĵ⻯�أ���������������Һ�������ԣ�ʹClO2ת��Ϊ![]() �����������Һ����Һ������
�����������Һ����Һ������
������0.0010 mol/LNa2S2O3��Һ�ζ�����I�в�����I2����֪������II�з�����Ӧ�����ӷ���ʽ��![]()
�ٲ���I�з�����������ԭ��Ӧ�����ӷ���ʽ��________��
�ڵ�����II�г���________��������ʱ��ֹͣ�μ�Na2S2O3��Һ����¼�����Ϊ10.00 mL��
������ˮ����ClO2�IJ���Ũ����______mg��L-1��
���𰸡�![]() ������Ӧ��
������Ӧ��![]() ��������
��������![]() ����Һ����
����Һ����![]() ������Ӧ��
������Ӧ��
![]() ��
��![]() һ�����ݳ���һ����ѭ����Ӧ ����
һ�����ݳ���һ����ѭ����Ӧ ���� ![]() ��Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ��������ΪClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ���
��Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ��������ΪClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ��� ![]() ��Һ��ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫ 0.675
��Һ��ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫ 0.675
��������
(1)����Ԫ�ػ��ϼ����߲���O2���������������ɣ�
�ڸ���װ��ͼ��![]() �������õ�������
�������õ�������![]() ��
��![]() ����Һ��ClO3-��Ӧ����
����Һ��ClO3-��Ӧ����![]() ��
��
��2���ٸ��ݱ������ݣ���֪����NaCl������![]() ��������������
��������������
���ܷ�Ӧ����Ӧii�ɵ÷�Ӧi��
�۸���ClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ���������Ӧi��ii��iii�����ʴ�С��
��3���ٲ���I��ClO2������ӷ�Ӧ����![]() �͵ⵥ�ʣ�
�͵ⵥ�ʣ�
�ڵ��ⵥ����ȫ��Ӧʱ����Һ��ɫ��ʧ��
�۸���![]() ��
��![]() ����֪ClO2��
����֪ClO2��![]() �Ĺ�ϵʽ�����ݹ�ϵʽ����ClO2����Ũ�ȡ�
�Ĺ�ϵʽ�����ݹ�ϵʽ����ClO2����Ũ�ȡ�
(1)��ˮ����Ԫ�ػ��ϼ����߲���O2���������������ɣ�������Ӧʽ��![]() ��
��
�ڸ���װ��ͼ��ClO2�IJ��������ǣ�����������Ӧ![]() ��������
��������![]() ����Һ����
����Һ����![]() ������Ӧ��
������Ӧ��![]() ��
��![]() һ�����ݳ���һ����ѭ����Ӧ��
һ�����ݳ���һ����ѭ����Ӧ��
��2�����ݱ������ݣ���֪����NaCl������![]() ������������������NaCl����Ҫ����������Ӧ�Ĵ�����
������������������NaCl����Ҫ����������Ӧ�Ĵ�����
���ܷ�Ӧ�����ӷ���ʽ��![]() ���ܷ�Ӧ����Ӧii�ɵ�
���ܷ�Ӧ����Ӧii�ɵ�
![]() ��
��
�۸���ClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ��������Է�Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ������
��3���ٲ���I��ClO2������ӷ�Ӧ����![]() �͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��
�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��![]() ��
��
�ڵ��ⵥ����ȫ��Ӧʱ����Һ��ɫ��ʧ��������II����ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫʱ���ﵽ�ζ��յ㣬ֹͣ�μ�Na2S2O3��Һ��
�۸���![]() ��
��![]() ����֪ClO2��
����֪ClO2��![]() �����ʵ�������1:1��
�����ʵ�������1:1��
��ˮ����ClO2�����ʵ�����nmol��
ClO2�D�D�D�D�D![]()
1 1
nmol 0.0010 mol/L��0.01L
���n=1��10 -5mol��
ClO2�IJ���Ũ����1��10 -5mol��67.5g/mol��103��1L=0.675 mg��L-1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ����Һ����H2O�⣬����CCl4��I2��I- �ȣ��л��յ⣬ʵ��������£�

��1�����Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI���������ӷ���ʽΪ___________���ò�����I2��ԭΪI����Ŀ����________��
��2������X������Ϊ__________��
��3������ʱ��������ƿ�н���I����ˮ��Һ���������pHԼΪ2������ͨ��Cl2����40�����ҷ�Ӧ��ʵ��װ����ͼ��ʾ����ʵ������ڽϵ��¶��½��е�ԭ����________������a������Ϊ__________������b��ʢ�ŵ���ҺΪ________��

��4����֪��![]() ��ij�����ˮ��pHԼΪ8����һ������I2�����ܴ���I����
��ij�����ˮ��pHԼΪ8����һ������I2�����ܴ���I����![]() �е�һ�ֻ����֡��������������麬���ˮ���Ƿ���I����IO3-��ʵ�鷽����ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ����
�е�һ�ֻ����֡��������������麬���ˮ���Ƿ���I����IO3-��ʵ�鷽����ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ����
��ȡ���������ˮ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���еⵥ�ʴ��ڣ�
��______________________��
������ˮ����ȡ������Һ������1-2mL������Һ���������ữ�μ�Na2SO3��Һ������Һ����˵����ˮ�к���IO3-������˵����ˮ�в�����IO3-��
��5���������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ�����������ˮ�������������������Ժ���Һ���յ⡣���ClO2����I�������ӷ���ʽ��_____ClO2+ ____I��+_______=_____![]() +_____Cl��+��_________��________��
+_____Cl��+��_________��________��
��6��������������һ�ֲⶨS2����������Ч���������·�ZnS��BaSO4��һ�ֳ��õİ�ɫ���ϣ��Ʊ������л��������Ե�BaS�������������������ⶨ���·���Ʒ��S2���ĺ�������ȡm g��Ʒ�����ڵ���ƿ�У���ȡ25.00mL 0.1000mol/L ��I2-KI��Һ�����У�������������Һ���ܱգ��ð�����Ӧ5min���е������������Ե���Ϊָʾ����������I2��0.1000mol/L Na2S2O3 �ζ�����ӦʽΪ![]() ���ⶨ����Na2S2O3��Һ���V mL�����·���ƷS2������Ϊ__________��д������ʽ��
���ⶨ����Na2S2O3��Һ���V mL�����·���ƷS2������Ϊ__________��д������ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���pH���������ͬ��HCl��CH3COOH��Һ�ֱ��ˮϡ�ͣ���pH���ˮ����ı仯��ͼ��ʾ������������ȷ����
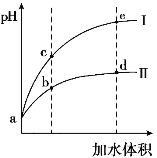
A.����II����HCl��ϡ����
B.��Һ��ˮ�ĵ���̶ȣ�b�㣾c��
C.��b�㵽d�㣬��Һ��![]() ���ֲ���
���ֲ���
D.���¶��£�b��Kw����ֵ��e���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��Դ�����õķ���֮һ�Ǻϳɶ����ѣ�CH3OCH3����
��1��CO2 ������ϳɶ����ѵĹ�������Ҫ�������з�Ӧ����ӦI��CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g)
CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
�� _____
��2 CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
��2��L��L1��L2����X�ֱ����ѹǿ���¶ȣ���ͼ��ʾLһ��ʱ����ӦII�ж����ѵ�ƽ�������X�仯�Ĺ�ϵ������X��������������_____���ж�L1��L2�Ĵ�С�����������ɣ�_____��

��3����ѹʱ����CO2��H2��ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ����![]() �����¶ȱ仯��ͼ��
�����¶ȱ仯��ͼ��

��t �� ʱ����ʼͶ��a molCO2��b mol H2���ﵽƽ��ʱ��ӦII���ĵ�H2�����ʵ���Ϊ______mol��
���¶ȸ���300����CO2ƽ��ת�������¶����߶������ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Һ����Ҫ�ɷ�ΪNaClO��������һ������NaOH����������������ʵ�ķ���ʽ�в��������ǣ���֪������NaClO��Һ��pHԼΪ11��
A. ������Һ����NaOH��Һ����Cl2�Ʊ���Cl2+2OH��="==" Cl��+ ClO��+ H2O
B. ������Һ��pHԼΪ12��ClO��+ H2O![]() HClO+ OH��
HClO+ OH��
C. ������Һ�����飨��Ҫ�ɷ�ΪHCl�����ã�����Cl2��2H��+ Cl��+ ClO��= Cl2��+H2O
D. ������Һ�Ӱ״�����HClO������ǿƯ�����ã�CH3COOH+ ClO��= HClO+CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.CO2����Ҫ�Ļ���ԭ�ϣ�Ҳ��Ӧ�ù㷺�Ļ�����Ʒ��CO2��������ƻ������ط�Ӧ�ɲ���������������м��㣺
(1)CO2ͨ�백ˮ����NH4HCO3��NH4HCO3�����ֽ⡣2.00mol NH4HCO3��ȫ�ֽ⣬�ֽ���ᆳ���������Ϊ_________L(��״��)��
(2)ijH2�к���2.40 molCO2���û������ͨ��2.00 L NaOH��Һ�У�CO2����ȫ���ա����NaOH��ȫ��Ӧ����NaOH��Һ��Ũ��Ϊ_______��
(3)CO2��KO2�����з�Ӧ��
4KO2+2CO2��2K2CO3+3O2 4KO2+4CO2+2H2O��4KHCO3+3O2
��9 mol CO2���ܷ���ں�KO2��Ӧ������9 molO2����Ӧǰ�ܷ����H2O����Ӧ����______________��
(4)�����ˮ������Ӧ�IJ����Ǻϳɼ״���ԭ�ϣ�CH4+H2O![]() CO+3H2
CO+3H2
��֪��CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4��ȫ��Ӧ��IJ����У�����100 mol CO2��ϳɼ״�������ü״�350 mol����������120 mol������CO2��ת����_______
��.����ƴ������ʯ��ʯ�ֽ⡢����ˮ���ơ�����ˮ̼�ữ�Ȼ������衣������м��㣺
(5)CaCO3��������Ϊ0.90��ʯ��ʯ100 kg��ɷֽ����CO2_______L(��״��)��ʯ��Ҥ�У���ʯ��ʯ100 kg�뽹̿��ϱ��գ�����CO2 29120 L(��״��)�����ʯ��ʯ��̼�����ȫ�ֽ⣬�ҽ�̿��ȫȼ�գ�������CO����̿�����ʵ���Ϊ_______mol��
(6)��֪����ˮ��MgCl2 6.80 mol/m3����CaCl2 3.00mol/m3�������ˮ�м���Ca(OH)2��þ���ӣ�MgCl2 + Ca(OH)2 �� Mg(OH)2�� + CaCl2Ȼ�����Na2CO3�������ӡ�������������ˮ10 m3��������Ҫ��Na2CO3______g�������̼�ữβ��(��NH3�������Ϊ0.100��CO2�������0.040)����̼���ƣ��������·�Ӧ��Ca2+ + 2NH3 + CO2 + H2O �� CaCO3�� + 2NH4+��������10 m3����ˮ������Ҫͨ��_____________L(��״��)̼�ữβ����
(7)ij����ˮ���Ȼ���1521 kg��ͨ�������̼������̼�����ƾ��壬���˺���Һ�к��Ȼ��1070 kg��
�ٹ��˺���Һ���Ȼ��Ƶ�����______________��
��������̼�����ƾ��������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£�ˮ��Һ��H+��OH-��Ũ�ȱ仯������ͼ������˵����ȷ���ǣ� ��
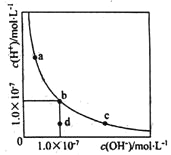
A. �����¶ȣ�����������c��b�ı仯
B. ���¶��£�ˮ�����ӻ�����Ϊl.0��10-13
C. ���¶��£�����FeCl3����������b��a�ı仯
D. ���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��������˵����ȷ���ǣ� ��

A.Z��N����Ԫ���γɵĻ����������ӻ�����
B.ͨ��M��N�����������ǿ�������ԱȽ����ߵķǽ�����
C.Z���������ֱܷ��ܽ���Y�����������N���⻯���ˮ��Һ��
D.��X��M����Ԫ����ɵĻ���������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ
c ��ˮϡ�� d �������������ƾ���
��2����0.1 mol��L-1 NaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�

�ٵζ������������___________������I��������������
�ڵζ���ʼǰ��0.1 mol��L-1 NaOH��0.1 mol��L-1�������0.1 mol��L-1����������Һ����ˮ�������c(H+)������_______��Һ��
��ͼI�У�V=10ʱ����Һ�е�c(H+)_________c(OH-) ������>��������������<������ͬ����c(Na+)_________c(CH3COO-)��
��3���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��4��ú̿��ҵ�о������������SO2��Ϊ��ֹ��Ⱦ���������������շ����д������������ʿ���������SO2����____________��
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
��5���±��Ǽ��ֳ�������ĵ��볣��
��ѧʽ | CH3COOH | H2SO3 | HClO | H2CO3 |
���� ���� | 1.8��10-5 | K1=1.23��10-2 K2=6.6��10-8 | 3.0��10-8 | K1=4.4��10-7 K2=4.7��10-11 |
/span>
���·�Ӧ��Ӧ�����ӷ���ʽ��ȷ����___________��
A Na2CO3��Һ��������SO2��CO32-+SO2+H2O = SO32-+HCO3-
B Ư��Һ��Ч��ԭ����ClO-+CO2+H2O = HClO+HCO3-
C ����������Һ��������SO2��ClO-+SO2+H2O = HClO+SO32-
D �����ˮ���е�CaCO3��2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com