
����Ŀ��NaCl��Һ�л���Na2SO4��CaCl2��Һ�͵��۽��壬ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���壮��Ӧ��ʵ�������ͼ��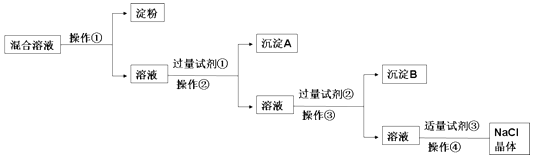
��1��д������ʵ������������Լ����Լ������Լ��� ��
��2���ж��Լ����ѹ����ķ����ǣ� ��
��3�������������ð�Ĥ���з����ᴿ�������ٵ�ʵ��������������ܡ����ܡ���
����Ĥ��SO42������ܡ����ܡ�������Ĥ��
��4�������ܵ������� ��
��5��ʵ�������Ƶõ�NaCl��������480mL1.0mol/L��NaCl��Һ����������ƽ�������Ȼ��ƹ���������� �� ���ƹ����õ��IJ�����������Ͳ���ձ�����ͷ�ι��⣬���� �� �������²��������Ƶ���ҺŨ����ɵ�Ӱ�죬Ӱ��ƫ�ߵ��� ��
������ˮϴ������ƿ��û�к�� ��ת����Һ�����г���©Һ
���ܽ��δ����ȴ��ת�Ƶ�����ƿ �ܶ���ʱ����
��ҡ�Ⱥ���Һ�潵�ͣ��ټ�����ˮ��
���𰸡�
��1��BaCl2,HCl
��2������,���ϲ���Һ�еμ������Ȼ�����Һ,�ް�ɫ��������,˵���Ȼ�����Һ�ѹ���
��3������,��
��4�������ᾧ
��5��29.3g,500mL����ƿ��������,�ۢ�
���������⣺��1�������Ϸ�����֪�Լ���ΪBaCl2���Լ���ΪHCl��
��2���ж��Լ����ѹ����ķ����Ǿ��ã����ϲ���Һ�еμ������Ȼ�����Һ��û�а�ɫ����������˵���Ȼ�����Һ�ѹ�����
��3������Ϊ���壬����ֱ���ϴ�������Ĥ����������ӿ�����Ĥ��
��4������������Һ�õ����壬���������ᾧ�ķ�����
��5��Ӧ����500mL��NaCl�����ʵ���n=cV=0.5L��1.0molL��1=0.5mol��NaCl������Ϊ0.5mol��58.5g/mol=29.25g������ƽ�ľ�ȷ��Ϊ0.1g������������ƽʵ�ʳ�ȡNaCl���������Ϊ29.3g�����Ʋ����м��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬��ȴ��ת�Ƶ�100mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ������Ϊ��������ƽ��ҩ�ס��ձ�����������100mL����ƿ����ͷ�ιܣ�
������ˮϴ������ƿ��û�к����Ӱ�죬����ʱ��Ҫ��������ˮ���ݣ�
��ת����Һ�����г���©Һʹ���ʼ��٣�Ũ��ƫ�ͣ�
���ܽ��δ����ȴ��ת�Ƶ�����ƿ��ʹ��Һ�����ƫС��Ũ��ƫ�ߣ�
�ܶ���ʱ��������ƿ�̶��ߣ���Һ��Һ����ڿ̶��ߣ����ƫС��Ũ��ƫ�ߣ�
��ҡ�Ⱥ���Һ�潵�ͣ��ټ�����ˮ��ʹ��Һ���ƫ��Ũ��ƫС��
���Դ��ǣ���1��BaCl2��HCl����2�����ã����ϲ���Һ�еμ������Ȼ�����Һ���ް�ɫ����������˵���Ȼ�����Һ�ѹ�������3�����ܣ��ܣ���4�������ᾧ����5��29.3g��500mL����ƿ���������� �ۢܣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ������п�����ᷴӦ����ʹ��Ӧ��������ѡ�õķ�Ӧ������ȷ������ǣ� ��
��Ӧ��������п�� ��пƬ ��п�� ��5%���� ��10%���� ��15%���� ���� ������ˮ��ȴ ����� ��Ѹ�ٻ�Ϻ��ã�
A.�ۢޢߢ�
B.�ۢݢߢ�
C.�٢ܢ��
D.�ڢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����գ�
��1���ڶ���������Ԫ���У��ȼ���������Ԫ�صĵ縺���ɴ�С��˳��������Ԫ�ط��ű�ʾ��
��2��A��B��CΪͬһ�����ڽ���Ԫ�أ������±����ݷ�����CԪ���ڻ������е���Ҫ���ϼ�Ϊ��A��B��C����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳���� ��
������/kJmol��1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
��3����֪����������ӵĿռ�ṹ��ͼ��ʾ�� 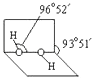 ��������ԭ�Ӳ�ȡ�ӻ���ͨ������£�H2O2��ˮ����Ȼ��ܵ���Ҫԭ���� ��
��������ԭ�Ӳ�ȡ�ӻ���ͨ������£�H2O2��ˮ����Ȼ��ܵ���Ҫԭ���� ��
��4��R��1��36��Ԫ����δ�ɶԵ���������ԭ�ӣ�R3+����Һ�д�������ת���� R3+ ![]() R��OH��3
R��OH��3 ![]() [R��OH��4]��
[R��OH��4]��
�ٻ�̬Rԭ�ӵļ۵����Ų�ʽΪ ��
��[R��OH��4]���д��ڵĻ�ѧ���� ��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D����λ��
��5���ȵ�����ԭ���ɹ�������Ϊ����ԭ������ȣ���ԭ��ָԭ��������4��ԭ�ӣ����ܵ�������۵�������ȵķ��ӻ����ӣ�����H2O2����Һ���У��ɵð�ɫ����A�����������ʾ��A���������������ӣ����������������壬��������H2O2��Ϊ�ȵ����壮��A�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȱ������������ֱ��������Ե��ǣ� ��
A. C��ŨHNO3B. Cu��ϡHNO3
C. CuO��ŨHNO3D. NaOH��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ԭ�����м���������̿�ۣ���Ͼ��Ⱥ������ڱ���NaCl��Һ��ʪ���ľ�֧�Թ��У�������Ƥ���������Ӻ�ֹˮ�У��۲쵽������ˮ���������Դ˹��������ķ�����ȷ���ǣ�������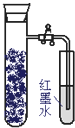
A.̼���ڵ绯ѧ��ʴ������������
B.̿�۱�����
C.������������ʴ
D.���������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ģ�����ĵ绯ѧ����װ�ã�����������ȷ���ǣ�������
A.��װ�����ڵ���
B.��װ���е������Ϸ���������Ӧ
C.�õ绯ѧ��������Ϊ����������������������
D.�õ绯ѧ��������Ϊ����ӵ�Դ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʴ��ÿ����ʴ����ʧ�ĸ���ռ���������������ķ�֮һ����ش�����ڸ�ʴ�����������е��й����⣮
��1��������ʴ��Ҫ��������ʴ���ø�ʴ���̵ĵ缫��ӦʽΪ������ �� ���� ��
��2�������ĸ�װ�ÿɷ�ֹ��������ʴ �� 
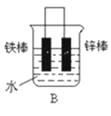
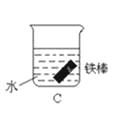
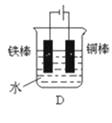
��3������Ʋ������ͭ���ȶ�п�������ױ���ʴ�����Ҫ˵��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1�����мס��ҡ�������ͬѧ�ֱ����Fe��OH��3������Ʊ�ʵ�飮��ͬѧ����1molL��1��FeCl3��Һ�м�����NaOH��Һ����ͬѧ��ֱ�Ӽ��ȱ���FeCl3��Һ����ͬѧ����25mL��ˮ����μ���5��6��FeCl3������Һ�������������Һ�ʺ��ɫ��ֹͣ���ȣ�
�Իش��������⣺
a�����в�����ȷ��ͬѧ�� ��
b��֤����Fe��OH��3�������ɵ�ʵ������� ��
c����֪ͬ�ֽ���������ͬ�ֵ�ɣ���ͬѧ�����Ƶõ�Fe��OH��3����װ��U�ι��ڣ���ʯī���缫��ͨ��һ��ʱ�������������������ɫ��������Fe��OH��3��������������������������ɣ�
��2��ijѧ������98% ����=1.84g/cm3������������6.0mol/L��H2SO4��Һ950mL����ش��������⣺
d��ʵ������98%����������ʵ���Ũ��Ϊmol/L��
e����ʵ����Ҫʹ�õ��IJ��������У���Ͳ���ձ�������������ͷ�ιܡ� ��
f�������Ʋ�������ʱ���۾����ӣ��������Ƶ���ҺŨ�Ƚ���ƫ��ƫС����Ӱ�죿��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȾԽ��Խ��Ϊ���ǹ�ע�����⣬�����е�NOx�����ѳ�����������������ŷţ�
��1����֪��CH4��g��+2O2��g���TCO2��g��+2H2O��1����H=��890.3kJmol��1N2��g��+O2��g���T2NO��g����H=+180kJmol��1
CH4���������������Ȼ�ѧ����ʽΪ��CH4��g��+4NO��g��=CO2��g��+2N2��g��+2H2O��1������H= ��
��2��C2H4Ҳ����������������Ϊ�о��¶ȡ�������Cu2+��������NOȥ���ʵ�Ӱ�죬������������һ����ʵ������ͼ1��ʾ��Ϊ�ﵽ��ߵ�NOȥ���ʣ�Ӧѡ��ķ�Ӧ�¶Ⱥ�Cu2+�������ֱ��� �� 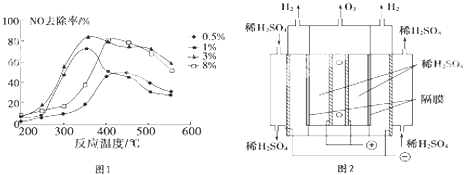
��3������Ҳ���������������� ��O3����NO ���ˮϴ�ɲ���HNO3��O2 ��
��һ�ֳ�������װ��ԭ����ͼ2��ʾ�����������Ե缫���ĵ缫��ӦʽΪ ��
�۽�ʯī�缫���óɿ���״��Ŀ���� ��
��4����ͼ3��һ����NH3�ѳ�������NO��ԭ���� 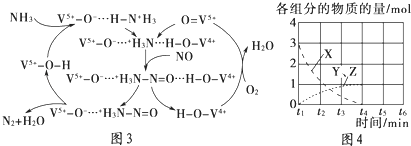
�ٸ�����ԭ���У�NO����ת��Ϊ���ѧʽ����
�ڵ�����2molNH3��0.5molO2ʱ����ȥ��NO�ڱ�״���µ����Ϊ ��
��5��NOֱ�Ӵ��ֽ⣨����N2��O2��Ҳ��һ������;�����ڲ�ͬ�����£�NO�ķֽ���ﲻͬ���ڸ�ѹ�£�NO��40���·ֽ��������ֻ������ϵ�и�������ʵ�����ʱ��仯������ͼ4��ʾ��д��Y��Z�Ļ�ѧʽ�� ��
��6��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2 �� ��֪9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol���˷�Ӧ�����ӷ���ʽ����ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ�д��ڵ���������Ũ�ȴ�С��ϵ��c��Na+���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com