
【题目】某原子的摩尔质量是Mgmol-1,则一个该原子的真实质量是( )
A.M/6.02×1023 g B.1/M g C.M g D.6.02×1023/M g
科目:高中化学 来源: 题型:
【题目】已知反应:①![]() ,②
,②![]() ,③
,③![]() ,下列说法正确的是
,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为![]()
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中![]() 还原剂反应则氧化剂得到电子的物质的量为
还原剂反应则氧化剂得到电子的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩尔质量为267 g/mol。
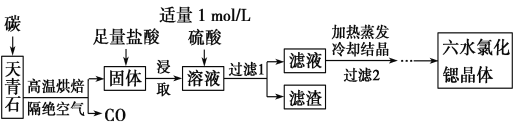
(1) 工业上天青石焙烧前先研磨粉碎,其目的是______________。
(2) 工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于___________mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.200 0 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些量不再发生变化时,表明下述反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态:
C(g)+D(g)已达到平衡状态:
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度④气体的总物质的量
⑤混合气体的平均相对分子质量
⑥物质C的百分含量 ⑦各气体的物质的量
⑧当有1molB气体分子断键,同时有1/2molC气体分子断键
A.②③⑤⑥⑦⑧ B.①②③⑥⑦⑧ C.②③④⑤⑥⑧ D.①③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相等的A、B两种气体,下列说法中错误的是( )
A. 分子数目一定相等
B. 体积一定相等
C. 质量不一定相等
D. 分子中的原子数目可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应生成氮气和气态水的热化学方程式:________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ____________________。
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
2NH3(g) △H=bkJmol﹣1,其化学平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
写出该反应的化学平衡常数的表达式: ,b 0(填“大于”、“小于”或“等于”)
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为______________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为___________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=__________(不考虑溶液体积变化) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com