
【题目】在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.1mol/L,则在这段时间内
用HI表示的平均反应速率为( )
A.0.01molL﹣1min﹣1
B.0.04molL﹣1min﹣1
C.0.2molL﹣1min﹣1
D.0.5molL﹣1min﹣1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
①用化学用语解释FeCl3溶液呈酸性的原因:。
②下列实验方案中,能使FeCl3溶液pH升高的是(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:。
② 用离子方程式解释反应后溶液为浅绿色的原因:。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A. 3∶5 B. 5∶4 C. 1∶1 D. 5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.1molH2O的质量是18g/mol
B.CO2的摩尔质量是44g/mol
C.硫酸的摩尔质量是98g
D.HCl的相对分子质量是36.5g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: 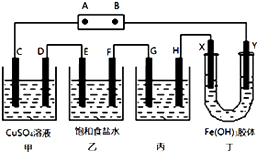
(1)电源A 极的名称是(正极或负极).
(2)甲装置中的C极的电极反应式 .
(3)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的主要成分是(填化学式).
(4)装置丁中的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分: 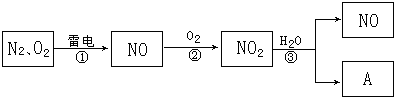
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油. 请回答下列问题: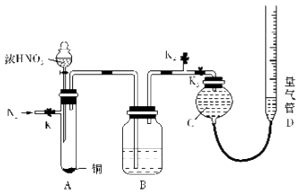
(1)加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .
(2)关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.
(3)读取量气管读数时,要先 , 然后再读取读数.
(4)数据分析:①从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 . ②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》冲收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和精人甑,蒸令气上……其清如水,球极浓烈,盖酒露也。”这里所用的“法”悬指
A. 萃取 B. 过滤 C. 蒸馏 D. 干馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com