
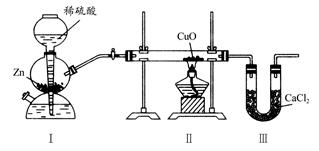
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B.Ⅲ装置后缺少干燥装置 |
| C.Ⅱ装置中玻璃管内有水冷凝 |
| D.CuO没有全部被还原 |
科目:高中化学 来源:不详 题型:实验题
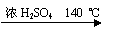 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
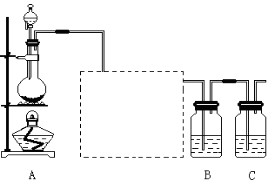
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测Zn的相对原子质量可以通过测Zn的质量以及这些Zn和过量的稀硫酸反应时放出H2的体积 |
| B.测Na2CO3、NaHCO3混合物中Na2CO3的质量分数可以通过测样品的质量及样品和过量Ba(OH)2溶液反应的沉淀的质量 |
| C.测中和热时,可以用稀氨水代替NaOH溶液 |
| D.将淀粉溶液滴入某混合液中,检验是否含有碘化钾 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 装 置 |  | 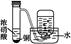 | 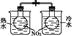 |  |
| 实 验 | 结合秒表粗略测量锌与硫酸的反应速率 | 制备并收集少量NO气体 | 验证温度对化学平衡的影响 | 铁的析氢腐蚀实验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
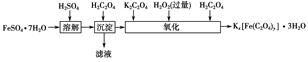
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
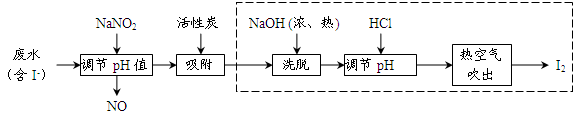
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
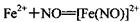 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com