
 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:  | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
分析 (1)升高温度,化学平衡向着吸热方向移动,物质的燃烧反应是放热的,大多数的化合反应是放热的,化学平衡常数等于产物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值,据此回答;
(2)化学反应中各物质表示的速率之比等于系数之比,根据三行式计算平衡常数;
(3)A.混合物在不同时刻的密度等于混合物的质量和体系的体积的比值;
B.T1温度时,混合气体的平均相对分子质量等于质量和物质的量的比值;
C.T2温度时,当c(SO2)=c(SO3)时,正逆反应速率不一定相等;
D.T1、T2温度下分别达到化学平衡状态时,压强和物质的量成正比.
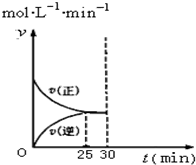
(4)在T1温度下30min时将容器的体积缩小至0.5L,压强增加,所以正逆反应速率都增加,但是平衡正向移动,所以正反应速率大于逆反应速率.
解答 解:(1)二氧化硫和氧气的化合反应是放热的,所以a小于零,升高温度,化学平衡向着吸热方向移动,逆向移动,所以三氧化硫的平衡浓度减小,所以T1<T2,该反应的表达式为K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$;故答案为:<;<;$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$;
(2)T1温度下,0~10min内化学反应速率v(SO3)=$\frac{0.3mol/L}{10min}$=0.03mol•L-1•min-1,反应中各物质表示的速率之比等于系数之比,所以0~10min内化学反应速率v(O2)=$\frac{1}{2}$×0.03mol•L-1•min-1=0.015 mol•L-1•min-1,
T2温度下:2SO2(g)+O2(g)?2SO3(g)
初始浓度:1 1 0
变化浓度:0.4 0.2 0.4
平衡浓度:0.6 0.8 0.4
K=$\frac{0.{4}^{2}}{0.{6}^{2}×0.8}$=0.56,故答案为:0.015;0.56;
(3)A.T1温度时,混合物在不同时刻的密度等于混合物的质量和体系的体积的比值,反应进行后质量守恒,体系体积不变,所以密度始终不变,即反应在10min时的混合气体密度和30min时密度相等,故A错误;
B.T1温度时,混合气体的平均相对分子质量等于质量和物质的量的比值,所以相对分子质量之比和物质的量成反比,反应在10min时与30min时气体的物质的量不同,所以
反应在10min时的混合气体的平均相对分子质量与30min时不相等,故B错误;
C.T2温度时,当c(SO2)=c(SO3)时,正逆反应速率不一定相等,不一定达到化学平衡状态,故C错误;
D.T1、T2温度下分别达到化学平衡状态时,根据变化量之比等于系数比,得到T1温度下,混合物的物质的量是1.75mol,T2温度下,混合物的物质的量是1.8mol,压强和物质的量成正比,即T1温度下压强小.
故选D.
(4)在T1温度下30min时将容器的体积缩小至0.5L,压强增加,所以正逆反应速率都增加,但是平衡正向移动,所以正反应速率大于逆反应速率,图象如下图所示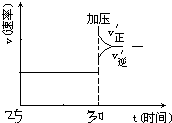 ,故答案为:
,故答案为: .
.
点评 本题涉及平衡常数的计算、反应速率的计算以及反应速率和平衡移动之间的关系图象知识,属于综合知识的考查,难度中等.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
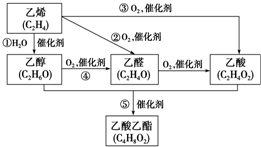 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: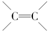 ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
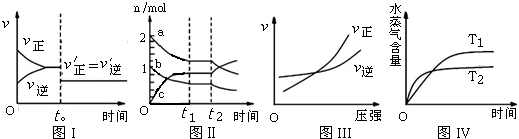
| A. | 图I:反应H2+I2═2HI 达平衡后,t0时降低温度反应速率随时间的变化 | |
| B. | 图Ⅱ:反应2SO3═2SO2+O2 达平衡后,扩大容器体积时各成分的物质的量随时间的变化(图中a、b、c分别代表SO2、O2、SO3的物质的量的变化曲线) | |
| C. | 图III:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 | |
| D. | 图IV:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5 mol HCl | B. | 2.5 mol H2O | ||
| C. | 108.5 g 33.6%的盐酸 | D. | 145 g 50.3%的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若质量相等,则质子数一定相等 | B. | 若原子数相等,则中子数一定相等 | ||
| C. | 若分子数相等,则体积一定相等 | D. | 若密度相等,则体积一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
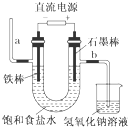
| A. | 装置中,a管能产生氢气 | |
| B. | 在石墨棒电极区域有NaOH产物 | |
| C. | b管导出的是氯气 | |
| D. | 以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com