
【题目】下列离子方程式正确的是( )
A. 铜片插入到硝酸银溶液中 Cu + Ag+![]() Cu2+ + Ag
Cu2+ + Ag
B. 硫酸镁跟氢氧化钡反应 Ba2++SO42-![]() BaSO4↓
BaSO4↓
C. 三氯化铁溶液与氢氧化钠溶液反应: FeCl3+3OH-![]() Fe(OH)3↓+3Cl-
Fe(OH)3↓+3Cl-
D. 氢氧化钠溶液和硫酸溶液反应 H++OH-![]() H2O
H2O
科目:高中化学 来源: 题型:
【题目】过氧化氢酶是能催化H2O2分解的一种生物催化剂,在动植物的器官中都有一定量的存在。某农村中学实验小组为节约开支,选择在绿色植物中寻找良好的生物催化剂,以备学生实验之用。根据当地实际,选择新鲜土豆、辣椒、苦卖菜叶,其实验分为如下几个步骤:(各步均在室温下进行)
Ⅰ.(1)_______________________(填写实验目的)
各取3 g新鲜的土豆、辣椒肉、辣椒籽、苦卖菜叶并剪成米粒大小,分别与3 mL 10%的H2O2溶液混合于如图所示的锥形瓶中,测定产生40 mL气体所用时间,实验记录如下表所示:
催化剂 | 新鲜的土豆 | 新鲜的辣椒肉 | 新鲜的辣椒籽 | 新鲜的苦荬菜叶 |
时间 | 140 s | 160 s | 175 s | 25 s |
结论:新鲜的苦荬菜叶对H2O2的分解催化效果最好。
(2)催化剂用量对反应速率的影响
分别称量2.0 g、2.5 g、3.0 g、3.5 g、4.0 g的________作催化剂,与3 mL 10%的H2O2溶液混合,仍然测定产生40 mL气体所用时间。
催化剂质量 | 2.0 g | 2.5 g | 3.0g | 3.5g | 4.0 g |
时间 | 50 s | 26 s | 25 s | 42 s | 48 s |
结论:催化剂用量在2.53.0 g时催化效果最好。
(3)不同浓度的H2O2对反应速率的影响(该实验步骤及实验记录略)。
Ⅱ.(1)量气装置如下图所示。图中装置的三部分均被铁架台固定不动,在读取4 mL气体体积时,几次实验均未调节两管中液面相平,请问这对本实验有没有影响________,原因是______________________________________。
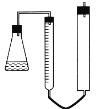
量气装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-。为了进一步确认,对该溶液进行实验检测:
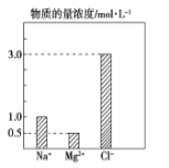
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无________。 | 肯定无该离子的理由______________。 |
步骤二 | 该溶液呈无色、透明、均一状态; | 肯定无________。 | 肯定无该离子的理由______________。 |
(1)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、 _________、干燥、在干燥器中冷却。
(2)原溶液中H+物质的量浓度为 __________mol/L。
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为:____________________________。
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,当Mg2+恰好沉淀完全时加入的Ba(OH)2溶液体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的保护方法的说法正确的是( )
A.我们使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后铁皮的腐蚀速率很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法
D.钢铁制造的暖气管道外常涂有一层沥青 ,这是钢铁的电化学保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2催化氧化过程中,不符合工业生产实际的是
A. 采用热交换器循环利用能量 B. 压强控制为20~50MPa
C. 反应温度控制在450℃左右 D. 使用V2O5作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=905.9 kJ/mol,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=905.9 kJ/mol,下列叙述正确的是
A.4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体的平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液与铝反应放出氢气.该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、CO32- 离子,试推断:若溶液呈酸性:一定大量含有_______离子;若溶液呈碱性:一定大量含有_____离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 12.0gNaHSO4固体中含阳离子数为0.1NA
B. 1mol的氯气溶于足量的水所形成的溶液中含氯离子数为NA
C. 标准状况下,22.4L苯中所含分子数为NA
D. 7.8gNa2O2与足量的水反应转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com