
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl- 几种微粒,其中N2、ClO- 的物质的量随时间变化的曲线如图所示。下列说法正确的是

A.该反应中Cl- 为氧化产物
B.消耗1mol还原剂,转移3mol电子
C.反应后溶液的碱性增强
D.该反应氧化剂与还原剂物质的量之比为2:3
【答案】B
【解析】
由曲线变化可知,随着反应进行,N2的物质的量增大,故N2是生成物,则NH4+应是反应物,N元素化合价发生变化,具有氧化性的ClO-为另一反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式:3ClO-+2NH4++2OH-=N2↑+5H2O+3Cl-,以此分析解答。
反应的方程式为:3ClO-+2NH4++2OH-=N2↑+5H2O+3Cl-。
A.由方程式可知,N元素的化合价升高,则N2为氧化产物,A错误;
B.由方程式可知还原剂为NH4+,其中N元素的化合价由-3价升高到0价,则消耗1mol还原剂转移3mol电子,B正确;
C.由方程式可知反应在碱性条件下发生,反应消耗OH-,反应后溶液的碱性减弱,C错误;
D.反应3ClO-+2NH4++2OH-=N2↑+5H2O+3Cl-中氧化剂为ClO-,还原剂为NH4+,故氧化剂与还原剂物质的量之比为3:2,D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A. 11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA
B. 含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA
C. 密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA
D. 4.0 g CO2气体中含电子数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
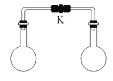
A.H2S和 SO2B.NH3和HCl
C.H2和Cl2D.NO和 O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 等均是我国发明的深紫外非线性光学晶体。
等均是我国发明的深紫外非线性光学晶体。
(1)![]() 三种元素的电负性由大到小的顺序是__________________,
三种元素的电负性由大到小的顺序是__________________,![]() 的第一电离能从大到小的顺序是______________________。
的第一电离能从大到小的顺序是______________________。
(2)基态钾原子的核外电子排布式为____________________;![]() 的熔点比
的熔点比![]() 的低,其原因是___________________________________________。
的低,其原因是___________________________________________。
(3)![]() 溶于25%的
溶于25%的![]() 溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵
溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵![]() 晶体,再在
晶体,再在![]() 气流中加热至450℃可得
气流中加热至450℃可得![]() 。
。
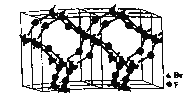
①气态![]() 是以单分子
是以单分子![]() 存在,固态
存在,固态![]() 的结构如图所示,气态
的结构如图所示,气态![]() 与固态
与固态![]() 的中心原子杂化方式依次为_____________、_________________。
的中心原子杂化方式依次为_____________、_________________。
②![]() 的空间构型为________________,画出
的空间构型为________________,画出![]() 的结构:_______________________.
的结构:_______________________.
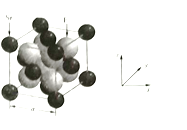
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,![]() 晶胞结构如图所示,品胞中与点
晶胞结构如图所示,品胞中与点![]() 距离最远的
距离最远的![]() 的原子分数坐标为_______________;
的原子分数坐标为_______________;![]() 的摩尔质量为
的摩尔质量为![]() ,晶胞的密度为
,晶胞的密度为![]() ,则晶胞参数
,则晶胞参数![]() ____________pm(用代数式表示)
____________pm(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,22.4LCl2含有的分子数目为NA
B.1.00mol/LCa(NO3)2溶液中含有的NO3- 离子数目为2NA
C.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
D.1molO2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1mol Na被完全氧化生成Na2O2,失去个NA电子
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 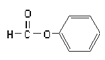 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有A12O3、Fe3O4、SiO2等杂质。已知从粉煤灰中回收镓的艺流程如图甲所示。
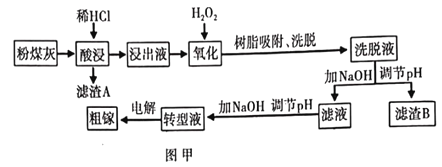
信息:(i)转型液中镓以GaO2-的形式存在;
(ii)Ksp[Ga(OH3)]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是___________。
(2)“氧化”过程中加入H2O2的目的是___________,该过程中发生反应的离子方程式为___________。
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],G a3+是否开始沉淀___________。
(4)流程图中两次调节pH的目的分别是___________。
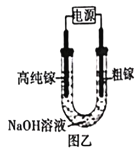
(5)电解法可以提纯粗镓,具体原理如图乙所示①粗镓与电源___________极相连(填“正”或“负”)。②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com