
分析 (1)铝、氧化铝、氢氧化铝当与氢氧化钠溶液反应生成偏铝酸钠;偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(2)Fe3O4的氧化物的写成FeO•Fe2O3,则四氧化三铁与稀硫酸反应生成硫酸铁和硫酸亚铁,据此写出反应的化学方程式;铁离子和亚铁离子同时存在时,具有亚铁离子需要用酸性高锰酸钾溶液;根据电子守恒计算出转移1mol电子生成氢氧化铁的物质的量;
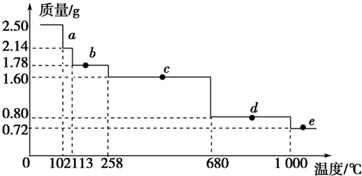
(3)Ⅰ.(1)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式计算失去水n值;
Ⅱ.根据产物性质及图象水解判断770℃时的反应产物,然后形成反应的化学方程式;氧化铜与稀硫酸反应生成硫酸铜,经浓缩、冷却析出的晶体为CuSO4•5H2O;
Ⅲ.根据Ⅱ可知1000℃后CuO加热分解,根据质量变化判断产物,然后写出方程式.
解答 解:(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应中都生成了NaAlO2,所以得到的溶液中溶质为偏铝酸钠;偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)Fe3O4的氧化物的表示形式可以写成FeO•Fe2O3,稀硫酸与四氧化三铁反应生成硫酸亚铁和硫酸铁,反应的化学方程式为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;
由于溶液中含有铁离子和亚铁离子,则检验亚铁离子选用酸性高锰酸钾溶液,方法为:取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则反应后的溶液中存在Fe2+;
Fe3O4中铁元素的化合价为+$\frac{8}{3}$价,氢氧化铁中铁元素的化合价为+3价,则生成1mol氢氧化铁转移的电子为(3-$\frac{8}{3}$)mol=$\frac{1}{3}$mol,则转移1mol电子生成氢氧化铁的物质的量为$\frac{1mol}{\frac{1}{3}}$mol=3mol,
故答案为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则反应后的溶液中存在Fe2+;3mol;
(3)Ⅰ.CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式可知:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
2.50g 2.50g-1.78g=0.72g,
解的:n=4
113~258℃时固体b的化学式为CuSO4•H2O,
故答案为:CuSO4•H2O;
Ⅱ.2.5gCuSO4•5H2O的物质的量为$\frac{2.5g}{250g/mol}$=0.01mol,完全失去结晶水后的质量为160g/mol×0.01mol,则258℃~680℃时为CuSO4,温度升高到680℃后硫酸铜分解生成黑色的氧化铜和三氧化硫,反应方程式为CuSO4$\frac{\underline{\;770℃\;}}{\;}$CuO+SO3↑,CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4•5H2O,
故答案为:CuSO4$\frac{\underline{\;770℃\;}}{\;}$CuO+SO3↑;CuSO4•5H2O;
Ⅲ.1000℃时氧化铜在加热条件下发生分解,根据图象可知,0.80g氧化铜加热后变为0.72g,0.80gCuO的物质的量为$\frac{0.80g}{80g/mol}$=0.01mol,含有铜的质量为:64g/mol×0.01mol=0.64g,则0.72g固体中含有的氧元素的质量为:0.72g-0.64g=0.08g,含有氧元素的物质的量为$\frac{0.08g}{16g/mol}$=0.005mol,则该产物的化学式为:Cu2O,根据化合价变化可知另一种产物为氧气,则该反应的化学方程式为4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑,
故答案为:4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑.
点评 本题考查金属的性质及含量的测定,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意氧化还原反应的应用及图象分析,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 苯甲酸的分子式为C6H5COOH,分子结构为
苯甲酸的分子式为C6H5COOH,分子结构为 ,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯.
,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯. +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.
+H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏 | |
| B. | 单质分子中均含共价键 | |
| C. | HF与HBr相比,分子内共价键更强,所以HF沸点更高 | |
| D. | 由不同元素组成的多原子分子里,只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | C的体积分数下降 | ||
| C. | 平衡向逆反应反向移动 | D. | A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com