
以下根据实验现象的推断,正确的是
A.能使润湿的碘化钾淀粉试纸变蓝的气体一定是Cl2
B.能使澄清石灰水变浑浊的无色气体一定是CO2
C.在潮湿空气中能形成白雾的气态氢化物一定是HCl
D.溶于水能形成无色溶液的红棕色气体一定是NO2
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++ H2O2 +2H+→2Fe3++ 2H2O、2Fe3++ H2O2 →2Fe2++ O2↑+2H+,下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中,溶液的pH逐渐下降
D.H2O2生产过程要严格避免混入 Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:实验题
(14分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe(NO3)3,但当铁过量时,产物是Fe(NO3) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是FeCl2 。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的C12中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。
探究过程如下:
提出假设:A是FeCl3,B是FeCl2 。
(1)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
实验方法 | 实验现象 | 结论 |
分别向A、B溶液中加KSCN溶液 | ____________________ | 固体物质中有FeCl3 |
分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(2)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式____________________。
(3)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____
(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为 。
方案2:在废液中加入适量的盐酸调节溶液的 pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,该电极上所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)____________________。
方案2在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反原理为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是
A.反应中氧化剂是Na2O2,还原剂是FeSO4
B.生成2 mol Na2FeO4时,反应中共有10 mol电子转移
C.Na2FeO4的氧化性大于Na2O2
D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
在由水电离产生的H+浓度为1×10? 13 mol · L-1的溶液中,一定不能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe3+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③④ C.③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市上学期高三第四次月考理综化学试卷(解析版) 题型:实验题
(选考)【化学——选修2:化学与技术】(15分)
实验室里用某工厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:
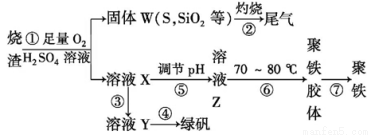
(1)若用浓硫酸配制过程①所需的250 mL 3.0 mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要 。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的 吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是 ,检验溶液X中金属阳离子是否完全转化的试剂为 (填试剂名称)。
(4)过程④的操作是将溶液 、 、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是 ___________________。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品3.200 g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
下列有关化学用语和表述正确的是:
A.元素铯的两种核素137Cs比133Cs多4个质子
B.S2-的结构示意图: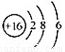
C.质子数为53,中子数为78的碘原子:131 53I
D.决定核素种类的微粒数是质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com