
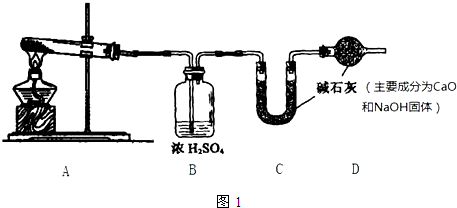
分析 方案一:根据装置图可知,碳酸氢钠在A中受热分解,生成二氧化碳和水蒸汽,混合气体通过浓硫酸吸水,根据浓硫酸的质量变化判断生成水的质量,再能过U形管中的碱石灰,吸收生成的二氧化碳,根据固体的质量的变化得出二氧化碳的质量,装置最后的干燥管中碱石灰可以防止空气中的水和二氧化碳对实验数据的干扰;
方案二:用碳酸氢钠与硫酸反应,依据滴定过程硫酸和碳酸氢钠反应的定量关系计算纯碳酸氢钠的质量,再根据$\frac{NaHC{O}_{3}的质量}{样品的质量}$×100%计算样品中NaHCO3的质量分数,根据配制一定物质的量的浓度溶液的实验要求,确定需要的仪器,根据实验操作中对$c=\frac{{n}_{B}}{{V}_{溶液}}$中的nB和V溶液的影响判断对溶液浓度的影响,据此答题.
解答 解:Ⅰ、方案一:根据装置图可知,碳酸氢钠在A中受热分解,生成二氧化碳和水蒸汽,混合气体通过浓硫酸吸水,根据浓硫酸的质量变化判断生成水的质量,再能过U形管中的碱石灰,吸收生成的二氧化碳,根据固体的质量的变化得出二氧化碳的质量,装置最后的干燥管中碱石灰可以防止空气中的水和二氧化碳对实验数据的干扰,
(1)碳酸氢钠在A中受热分解,生成二氧化碳和水蒸汽,反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)根据上面的分析可知,装置D的作用是吸收空气中的水和二氧化碳,
故答案为:吸收空气中的水和二氧化碳;
(3)完全反应时,若测得C装置在反应前后的质量差是2.0g,即生成的二氧化碳的质量为2.0g,设NaHCO3的质量为m,
根据方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
84×2 44
m 2.0g
所以m=$\frac{84×2×2}{44}$g=7.64g
样品中NaHCO3的质量分数为$\frac{7.64g}{10g}$×100%=76.4%,
故答案为:76.4%;
(4)此方案的实验结果数值偏小,可能的原因是CO2残留于AB装置中,未能在C中测出,
故答案为:CO2残留于AB装置中;
Ⅱ、方案二:用碳酸氢钠与硫酸反应,依据滴定过程硫酸和碳酸氢钠反应的定量关系计算纯碳酸氢钠的质量,再根据$\frac{NaHC{O}_{3}的质量}{样品的质量}$×100%计算样品中NaHCO3的质量分数,根据配制一定物质的量的浓度溶液的实验要求,确定需要的仪器,根据实验操作中对$c=\frac{{n}_{B}}{{V}_{溶液}}$中的nB和V溶液的影响判断对溶液浓度的影响,
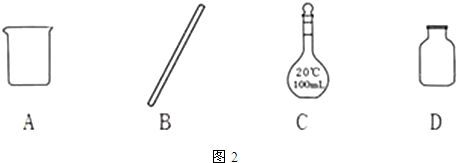
(1)①配制过程中需要用到烧杯、玻璃棒、容量瓶,不用集气瓶,
故选D;
②A、没有洗涤烧杯或玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,
B、如果加水超过了刻度线,取出水使液面恰好到刻度线,溶液浓度减小;
C、容量瓶洗净后没有干燥,对溶质的物质的量及最终溶液的体积都没有影响,所以不影响配制结果,
故答案为:C;
(2)滴加硫酸时反应的化学方程式是2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,
故答案为:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
(3)若测得消耗硫酸的体积为20mL,硫酸浓度为1mol/L
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2 1
n 1mol/L×0.02L
n=0.04mol
样品中NaHCO3的质量分数=$\frac{0.04mol×84g/mol}{4g}$×100%=84%;
故答案为:84%.
点评 本题考查了物质组成的实验探究和分析判断,主要是实验基本操作和定量计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 |  |  |  | |
| 化工 | 氯碱工业 | 高炉炼铁 | 铜的精炼 | 生产漂白粉 |
| 原理 | 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+ H2↑ | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 阴极: Cu2++2e-═Cu | 2NaOH+Cl2═NaCl+NaClO+H2O |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定有分子碰撞 | B. | 化学反应的活化能一定大于零 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 发生有效碰撞的分子是活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
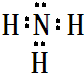 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式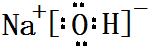 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.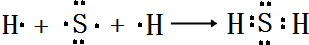 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根瘤菌把氮气转化为氨 | B. | 氮气和氢气在适宜条件下合成氨 | ||
| C. | 氮气和氧气在放电条件下合成NO | D. | 工业上用氨和二氧化碳合成尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该过程是一种新的硫酸生产方法 | |
| B. | C2H5OSO3H具有酸性 | |
| C. | 该过程中①、②是加成反应 | |
| D. | 该过程中③、④可看做酯类的水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com