
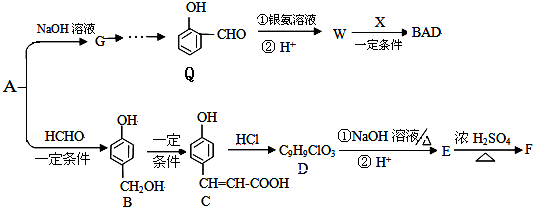
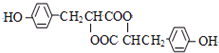
 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式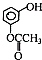
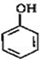 ,C和氯化氢发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应然后酸化得到E,结合F的结构可知,E发生酯化反应生成F,E的结构简式为
,C和氯化氢发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应然后酸化得到E,结合F的结构可知,E发生酯化反应生成F,E的结构简式为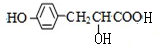 ,则D的结构简式为
,则D的结构简式为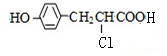 .A和氢氧化钠反应生成G为
.A和氢氧化钠反应生成G为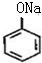 ,H和银氨溶液发生氧化反应然后酸化生成W,W的结构简式为:
,H和银氨溶液发生氧化反应然后酸化生成W,W的结构简式为: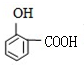 ,W和X反应生成BAD,根据BAD的结构简式知,X的结构简式为
,W和X反应生成BAD,根据BAD的结构简式知,X的结构简式为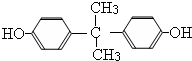 .
. ,C和氯化氢发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应然后酸化得到E,结合F的结构可知,E发生酯化反应生成F,E的结构简式为
,C和氯化氢发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应然后酸化得到E,结合F的结构可知,E发生酯化反应生成F,E的结构简式为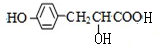 ,则D的结构简式为
,则D的结构简式为 .A和氢氧化钠反应生成G为
.A和氢氧化钠反应生成G为 ,H和银氨溶液发生氧化反应然后酸化生成W,W的结构简式为:
,H和银氨溶液发生氧化反应然后酸化生成W,W的结构简式为: ,W和X反应生成BAD,根据BAD的结构简式知,X的结构简式为
,W和X反应生成BAD,根据BAD的结构简式知,X的结构简式为 ,
,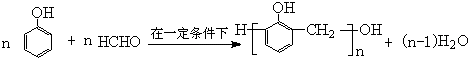 ,
, ;
; ,D1与足量稀NaOH水溶液反应的化学方程式:
,D1与足量稀NaOH水溶液反应的化学方程式: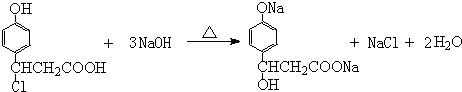 ,
, ;
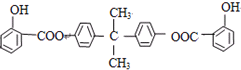
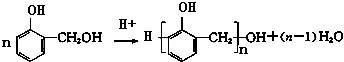
; ,X与间苯二甲酰氯(
,X与间苯二甲酰氯( )发生缩聚反应生成一种聚芳酯和氯化氢,属于取代反应,该聚芳酯的结构简式为:
)发生缩聚反应生成一种聚芳酯和氯化氢,属于取代反应,该聚芳酯的结构简式为: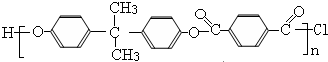 ,
, ;
; ;
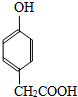
; )多一个碳原子的同系物,Y的同分异构体有多种,其中满足下列条件的Y的同分异构体:苯环上有两个间位取代基,其中一个含有羟基,且属于酯类,其中一种为
)多一个碳原子的同系物,Y的同分异构体有多种,其中满足下列条件的Y的同分异构体:苯环上有两个间位取代基,其中一个含有羟基,且属于酯类,其中一种为 ,变换酯基,可得其它同分异构体为:
,变换酯基,可得其它同分异构体为: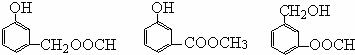 ,
, .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
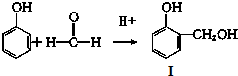
 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 待测混合溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 27.46 | 25.90 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入H2O2的主要作用是将溶液中的Fe2+氧化为Fe3+ |
| B、CuSO4?5H2O和Al2(SO4)3?18H2O均属于混合物 |
| C、实验室中过滤时可直接将滤液倒入有滤纸的漏斗中 |
| D、高锰酸钾溶液也可以氧化Fe2+,所以第②步中可以用酸性高锰酸钾溶液代替H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
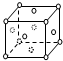 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 b.如果 |
| 步骤3: | 有白色沉淀生成,C的成分有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法是除去水中杂质得到纯净的水的最好方法 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
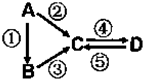 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com