
下列各项中表达正确的是( )
A.F-的结构示意图: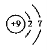 B.CO2的分子模型示意图:
B.CO2的分子模型示意图: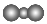
C.CSO的电子式: D.N2的结构式::N≡N:
D.N2的结构式::N≡N:
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学用语不能表示为2-丁烯的是
A.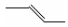 B. CH3CH=CHCH3 C.
B. CH3CH=CHCH3 C.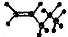 D.
D.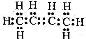
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:选择题
下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:选择题
下表为六种短周期元素的部分性质:
元素代号 | X | Y | Z | Q | R | T |
原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
下列有关说法错误的是( )
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物QX和XR4,其晶体类型不相同
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:选择题
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:
N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
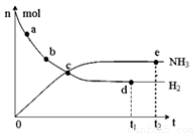
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:填空题
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。

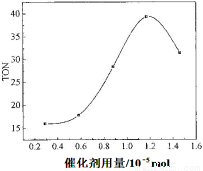
(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH- 、H+四种微粒浓度由大到小关系为: 。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:选择题
下列结论均出自《实验化学》中的实验,其中正确的是 ( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4能从中萃取出碘
B.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只要将溶液蒸干即可
C.用移液管取液后,将移液管稍倾斜放入垂直的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管
D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高二化学试卷(解析版) 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“=” )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有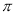 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
(5)D的氢化物的晶体结构如图所示,其化学式是 。
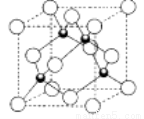
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.乙烯、苯、溴苯分子中的所有原子均共平面
B.水加热至1000℃以上才分解是因为水分子间存在着氢键
C.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸
D.能发生银镜反应的有机物结构中一定含有-CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com