
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为 。
(2)下列有关分子结构的说法正确的是 。
A.C2H4分子中有5个![]() 键处1个
键处1个![]() 键
键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是 。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)![]() -ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。

(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于 。
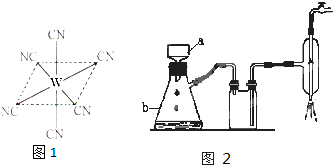
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为 。
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下:

实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是 。
(2)在反应中甲醇需过量,其原因是 。
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
在上述苯甲醛与甲醇缩合反应实验中催化剂铌酸的最佳用量为 。
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标。铌酸催化剂循环使用次数对产率的影响如右下图,这说明铌酸催化剂的优点之一是 。
(5)用铌酸作催化剂时,不同的醛与甲醇的缩合反应的转化率和产率如下表:
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 邻羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |

从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是 。
A.(12分),每空均为2分
(1)[Ar]3d74s2或1s22s22p63s23p63d74s2
(2)ABCD(漏选1—2个得1分,漏选2个以上不得分)
(3)C
(4)4
(5)氧离子半径比硫离子小,晶格能大
(6)8
B.(12分),每空均为2分
(1)该反应较慢,需在沸腾条件下反应较长时间,为了不使甲醇和苯甲醛的蒸汽逸了损失。(2分)
(2)提高苯甲醛的转化率(2分)
(3)0.05mol(2分)
(4)催化剂可重复多次使用,对产率的影响很少(只减少2%左右)(2分
(5)①相同取代基时,产率或转化率;邻位>间位;②不同取代基时,产率或转化率,供电子基团(羟基、烷基等)>吸电子基团(硝基、卤素等)(14分)
本卷当中所有合理答案,均参照给分


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有: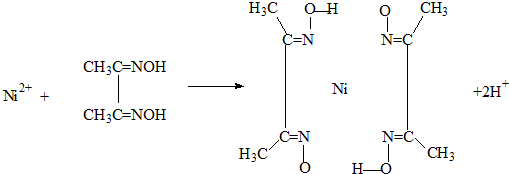
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% |
反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.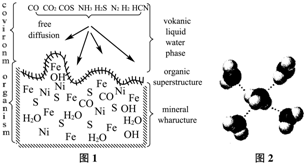
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com