
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________________________。利用反应6NO2+ 8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得平衡时NO2与SO2体积比为1∶6,则平衡常数K=_______________。
【答案】3NO2+H2O===NO+2HNO3 6.72 -41.8 ![]()
【解析】
(1)NO2用水吸收,根据氧化还原反应中电子得失进行计算;
(2)根据可逆反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)结合三段式进行计算。
SO3(g)+NO(g)结合三段式进行计算。
(1)NO2用水吸收,反应方式为:3NO2+H2O=NO+2HNO3;在6NO2+8NH3![]() 7N2+12H2O反应中,NO2化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=
7N2+12H2O反应中,NO2化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=![]() =0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
(2)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)可以由已知方程式(①+②)×
SO3(g)+NO(g)可以由已知方程式(①+②)×![]() 得到,所以ΔH=(ΔH1+ΔH2)×
得到,所以ΔH=(ΔH1+ΔH2)×![]() =-41.8kJ/mol;
=-41.8kJ/mol;
令NO2与SO2的起始物质的量分别为1mol、2mol,设平衡时参加反应的SO2的物质的量为xmol,则:
NO2(g)+SO2(g)SO3(g)+NO(g)
开始(mol):1 2 0 0
变化(mol):x x x x
平衡(mol):1-x 2-x x x
故(1-x):(2-x)=1:6,解得x=0.8,平衡常数K= =
=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A.①③⑤B.②③④C.②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(化学反应原理)
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)在相同时间内, 两烧杯中产生气泡的速度:甲__乙(填“>”“<”或“=”)。
(2)请写出图中构成原电池的负极电极反应式:__。
II.(化学与生活)
材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
(1)在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点___。(选填“高”或“低”)
(2)石英玻璃纤维又称光导纤维,其主要成分和NaOH溶液反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,C的焰色反应火焰呈黄色,E是红棕色的固体;X、Y是两种常见的单质,其中X常温常压下为气体.
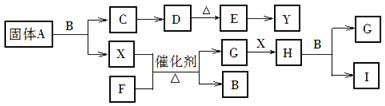
根据上面框图关系回答下列问题:
(1)A的化学式为______,常温下A的颜色为______,I的化学式为______.
(2)写出X+F![]() G+B的化学方程式:______.
G+B的化学方程式:______.
(3)写出实验室中用两种固体药品制取F气体的化学方程式:______.
(4)写出“![]() ”反应的离子方程式:______.
”反应的离子方程式:______.
(5)写出“![]() 金属单质
金属单质 两性氧化物”的化学方程式:______.
两性氧化物”的化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分之一,其相对分子质量为28,现以A为原料合成乙酸乙酯。请回答下列问题。
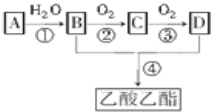
(1)结构简式:A____;C ___。
(2)写出化合物官能团名称:B____。
(3)写出反应的化学方程式④:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
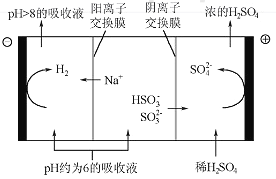
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com