

 .
. 分析 将A中的CH3COOH与Na2CO3发生反应生成大量气体二氧化碳,说明酸性CH3COOH>H2CO3;产生的CO2气体通入苯酚钠溶液发生反应生成苯酚:说明酸性H2CO3>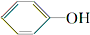 ,CH3COOH与Na2CO3反应生成二氧化碳和醋酸钠、水;二氧化碳与苯酚钠反应生成碳酸氢钠和苯酚,以此解答该题.
,CH3COOH与Na2CO3反应生成二氧化碳和醋酸钠、水;二氧化碳与苯酚钠反应生成碳酸氢钠和苯酚,以此解答该题.
解答 解:(1)醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH,根据强酸制取弱酸知,醋酸和碳酸钠反应制取二氧化碳,二氧化碳和苯酚钠溶液反应制取苯酚,所以仪器的连接顺序是:A→D→E→A→B→C→F,
故答案为:A;D;E;B;C;F;
(2)苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠,C中溶液变浑浊,故答案为:溶液由澄清变浑浊;
(3)CH3COOH与Na2CO3反应生成二氧化碳和醋酸钠、水,则其反应方程式为:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,二氧化碳与苯酚钠反应生成碳酸氢钠和苯酚,其反应方程式为 ,
,
故答案为:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑、 .
.
点评 本题考查了探究顺序强弱实验,侧重学生的分析能力的考查,明确物质的性质是解本题关键,结合强酸制取弱酸实验原理来分析解答,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:多选题

| A. | A、B、C三种物质中A的溶解度最大 | |
| B. | 通过蒸发溶剂的方法可将C从不饱和溶液变成饱和溶液 | |
| C. | 20℃时,100g水中溶解30g A可达到饱和 | |
| D. | 80℃时,100g水不能将50g B溶解完全,而能完全溶解50g C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++2I-═2Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2FeCl3+4FeI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com