
| A、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)>c(OH-)+c(CH3COO-) |
| B、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| D、pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
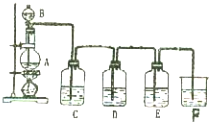 实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:
实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
| 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应mX(g)+nY(g)?pZ(g),在不同的温度(T1、T2)和不同的压强(P1、P2)下,产物Z的物质的量(n)与时间(t)的关系如图所示,则下列判断正确的是( )
可逆反应mX(g)+nY(g)?pZ(g),在不同的温度(T1、T2)和不同的压强(P1、P2)下,产物Z的物质的量(n)与时间(t)的关系如图所示,则下列判断正确的是( )| A、m+n<p |
| B、m+n>p |
| C、增大压强平衡向正反应方向移动 |
| D、升高温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量CH3COONa固体,平衡向正反应方向移动 |
| B、加水,反应速率变小,平衡向正反应方向移动 |
| C、滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 |
| D、加入少量NaOH固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com