
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
分析 (1)计算1mol甲烷完全燃烧放出的热量,注明物质的聚集状态与焓变书写热化学方程式;
(2)根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式,焓变也进行相应的计算;△G=△H-T△S<0,反应自发进行,△G=△H-T△S>0,反应不能自发进行;
(3)反应热=反应物总键能-生成物总键能.
解答 解:(1)在25℃、101kPa时,8g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则1mol甲烷燃烧放出的热量为:445.15kJ×$\frac{1mol×16g/mol}{8g}$=890.3kJ,则CH4燃烧的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;
(2)已知:①.C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
②.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
③.CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
根据盖斯定律,①-②-③可得:C(s)+H2O(g)═CO(g)+H2(g)△H=-437.3kJ•mol-1-(-285.8kJ•mol-1)-(-283.0kJ•mol-1)=+131.5kJ•mol-1,
如果该反应△S=+133.7J•K-1•mol-1,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行,
故答案为:+131.5;不能,常温(25℃)下,△G=△H-T△S=131.5kJ/mol-298K×0.1337kJ•K-1•mol-1=+91.66kJ/mol>0,反应不能自发进行;
(3)反应热=反应物总键能-生成物总键能,则N2+3H2?2NH3的△H=945kJ/mol+3×436kJ/mol-6×391kJ/mol=-93kJ/mol,即a=-93,
故答案为:-93.
点评 本题考查反应热有关计算、热化学方程式书写、反应自发性判断,注意理解反应热与键能的关系是解题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L氯气通入足量水中反应,转移的电子数为NA | |
| B. | 乙烯和氮气组成的28g混合气体中含有NA个分子 | |
| C. | 1molNa2O2中阳离子和阴离子数均为2NA | |
| D. | 1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
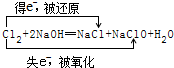
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.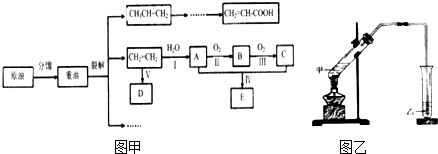
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com