
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
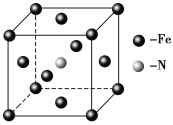
���𰸡���1��sp2�ӻ���5:1����2��O>N>C>H,NH3������������3��N2O����4��![]() ��
��
���Ӿ��壬0����5��Fe4N��![]() .
.
��������
���������ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�A��HԪ�أ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����B��CԪ�أ�Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�����B��CԪ�أ�����D��OԪ�أ�C��NԪ�أ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2����E��FeԪ�أ���1��C2H4������Cԭ�ӹ�����ӻ�����Ϊsp2�ӻ������ۼ������ǦҼ���˫������һ���Ǧм�����һ���ǦҼ���������ϩ�����ЦҼ��ͦм�������Ϊ5:1����Ϊ��sp2�ӻ���5:1����2����2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��ΪO>N>C>H,NH3�д��ڷ��Ӽ�������Էе�Ȼ�����CH4�ĸ�,��Ϊ��O>N>C>H,NH3������������3��N��һ���������C��һ�������ﻥΪ�ȵ����壬��ô�ֱ���N2O��CO2����Ϊ��N2O����4��Ԫ��E��FeԪ�أ��ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ![]() ����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��
����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��![]() �����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��
�����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��![]() +6��
+6��![]() =4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ
=4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ![]() acm����þ�����ܶ���
acm����þ�����ܶ���![]() g��mL-1����Ϊ��Fe4N��
g��mL-1������Fe4N��![]() .
.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��һ���¶��£�ij�ݻ�Ϊ2 L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯����������ͼ����ͼ��ʾ��

��1���÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2����ͼ����ʾ������ʱ���У�_______����t1��t2��t3��ʱ�̴ﵽ��ѧ��Ӧ����
II��һ���¶��½�6 mol A��6 mol B�����2 L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%��C��ƽ����Ӧ������0.36 mol/��L��min������
xC(g)+2D(g)������5���Ӻ�Ӧ�ﵽƽ�⣬���A��ת����Ϊ60%��C��ƽ����Ӧ������0.36 mol/��L��min������
��1��ƽ��ʱD��Ũ��=___________________��
��2��B��ƽ����Ӧ���ʦ�(B)= ___________________________��
��3��x=_________��
��4����ʼʱ�����е�ѹǿ��ƽ��ʱ��ѹǿ֮��Ϊ______________����Ϊ��������ȣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��̼���⡢������Ԫ����ɡ���ȡ3g A��4.48L��������״�������ܱ�������ȼ�գ�ȼ�պ����ɶ�����̼��һ����̼��ˮ���������跴Ӧ��û��ʣ�ࣩ������Ӧ���ɵ���������ͨ��Ũ����ͼ�ʯ�ң�Ũ��������3.6g����ʯ������4.4g���ش��������⣺
��1��3gA��������ԭ�ӡ�̼ԭ�ӵ����ʵ������Ƕ���?
��2��ͨ������ȷ�����л���ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���CO2��H2�Ʊ��״��Ĺ����к������з�Ӧ��
��Ӧ1:CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H1
CO(g)��H2O(g) ��H1
��Ӧ2:CO(g)��2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��Ӧ3:CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3
���Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3���������¶ȱ仯��������ͼl��ʾ����Ӧ1��3�Ļ����ͼ2��ʾ��
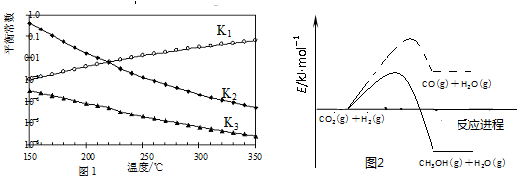
��1������H2________��H3(����������������������������)��������________��
��2����Ӧ1����S1______0(�������)��ָ���������Է����е��¶�����____(�����ϸ��¶��������ϵ��¶���)
��3���������Ϊ1:1��H2��CO2�����ݻ��ɱ��ܱ������ڣ���ֻ���з�Ӧ1�����д�ʩ����ʹƽ��ʱ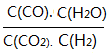 �������____________(�����)
�������____________(�����)
A�������¶�B������ѹǿC������һ������CO2 D���ټ���һ��������
��4��Ϊ�����CO2��H2�Ʊ��״�����Ч�ʺͲ�������ҵ������ͨ����ȡ����ʩ��____________
��5�����¶�Ϊ300��ʱ��ʹ���������������Ϊ��H2��CO2������㶨���ܱ������ڽ��з�Ӧ�����¶��·�Ӧ2���г̶Ⱥ�С�ɿ��ɲ����У�����ͼ3�л���CO��CH3OHŨ����ʱ��仯��ƽ��Ķ�������ͼ��
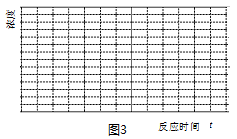
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ�ʳƷ���ϵ��л�������A������Է�������Ϊ120��Aȼ��ֻ���ɶ�����̼��ˮ��A�ȿ������Ҵ�����������Ӧ���ֿ��������ᷢ��������Ӧ���Ҳ��A���Ҵ���ȫ���������л�����B����Է�������Ϊ176����ش��������⣺
��1��A�ķ���ʽΪ ��
��2��B�Ľṹ��ʽ ��
��3��A�����ᷢ��������Ӧ�Ļ�ѧ����ʽ ��
��4���ɱ�ϩ��������������Ժϳ��л�������A���������£�
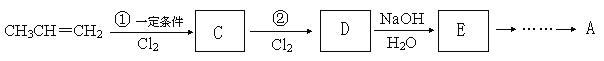
��C�ķ���ʽΪC3H5Cl��D�ķ���ʽΪC3H5Cl3����ٵķ�Ӧ����Ϊ ��
D��E��Ӧ�Ļ�ѧ����ʽΪ ��
�벹�����E��A�ķ�Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ҵ�ϳɰ�������������ͼ��
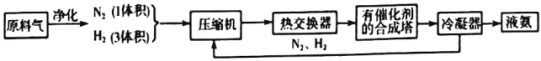
�ش�����������
��1���ϳ�������ĵ�����Դ��__________���ϳ���������ԭ��������������Ȼ���Ʊ�������Ҫ��ӦΪCH4(g)+H2O(g)=CO(g)+3H2(g)��CH4��O2�ķ�Ӧ��2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4��H2O(g)����������(O2�����ϸ�����ͬ��������������������ͬ)��Ϸ�Ӧ����������������±���
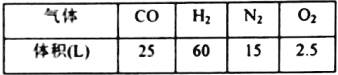
����ø���������O2��N2�������V(O2):V(N2)=__________��
��2���ںϳɰ���ԭ�����л��е����ʱ����ȥ��ԭ����__________��
�����������Ƚ�������������__________���Ӻϳ��������Ļ�����壬ͨ��������15%(�������)�İ���Ϊ���ԭ�ϵ������ʣ�ͨ����ȡ�Ĵ�ʩ��__________��
��3���ϳɵ�Ϊ���ȷ�Ӧ������ҵ�ϲ���400��-500�����¶�����Ҫԭ������
�����¶ȷ�Χ�ڷ�Ӧ���ʽϿ�����__________��
��4��������CO2��Ӧ�Ʊ�����(CO(NH2)2]����Ӧ���̷�Ϊ��������д���йصĻ�ѧ����ʽ��
�������������̼�ڼ��ȼ�ѹ�����»����������������(H2NCOONH4):__________��
��������������ȷֽ�Ϊ������ˮ��__________��
��5���·��ϳ��������õ�ⷨ�ϳɡ�����ѹ�½�������������ϡ�͵ĵ����ֱ�ͨ��һ�����ȵ�570���ĵ����У������͵����ڵ缫�Ϻϳ������������������IJ������·��ϳ������õĵ�����ܴ���H+���������ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ǰ����������Ԫ��A��B��C��D��E��F�ĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�AC�����ӻ�������е��������������һ�����Ӳ�.E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��FԪ�غ���������������Ѫ�쵰��Я�������Ĵ�С����ش�
��1��A��B��C��D�ĵ�һ��������С�����˳����__________(��Ԫ�ط������)
��2��������BD3�ķ��ӹ���Ϊ__________��B��ԭ�ӹ���ӻ�����Ϊ__________��BԪ���⻯��ķе������ͬ��������Ԫ�ص��⻯���ԭ����__________��
��3����֪F2+��KCN��Һ��Ӧ��F(CN)2���������������KCN��Һʱ�����ܽ⣬���������.��F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��CN-��__________(һ�ַ���)��Ϊ�ȵ�����.����CN-�綾�Եķ���֮һ�Ǽ���Ũ��˫��ˮ���ɽ���ת��Ϊ������̼���μ�������д���÷�Ӧ�����ӷ���ʽ��__________��
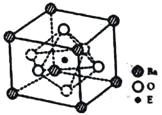
��4����E��̬ԭ�ӵļ۵����Ų�Ϊ__________����EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ__________��
����֪�þ����Ħ������ΪM(g/mol)������E4+������λ��Ϊ__________�����þ����߳�Ϊanm���ɼ���þ�����ܶ�Ϊ__________g/cm3(�����ӵ�����ΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��һ����ȡ������������Ϊԭ�Ͻ����ض���Ӧ��װ�ã��������������������bƿ�У����и��Լ�ƿ����װ�Լ�Ϊ��B(������)��C(�⻯�ص�����Һ)��D(ˮ)��F(��ɫʯ����Һ)��
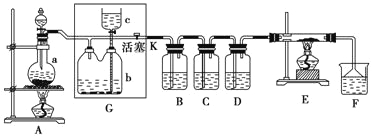
��1����A����ƿ�еĹ���ΪMnO2��Һ��ΪŨ���ᣬ���䷢����Ӧ�Ļ�ѧ����ʽΪ______��
��2����μ��װ��G�������ԣ�______��д����������������
��3��G��bƿ���˼����Һ����______��ʵ�鿪ʼ��B�е�������______��C�е�������______��F��������______��
��4��Eװ����Ӳ�ʲ�������ʢ��̿�ۣ���E�з���������ԭ��Ӧ�������Ϊ������̼���Ȼ��⣬д��E�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��������ѧ��ѧ����Ϥ�����ʣ�������������������
��O2 ��Na2O2 ��NH4Cl ��HCl ��NaOH ��CaCl2 ������
��1����Щ�����У�ֻ�����ۼ����� ��ֻ�����Ӽ����� ���Ⱥ����ۼ��ֺ����Ӽ����� ��
��2���������ӻ�������� ��
II.��1��20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��NO2��CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ��˵�������Ӧ�� ������ȡ����ȡ�����Ӧ��NO2��CO�������� ������ڡ�����С�ڡ����ڡ���CO2��NO����������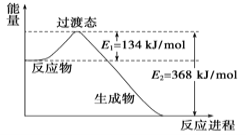
��2����֪��1molH��H����1mol I��I��1mol H��I���ֱ���Ҫ���յ�����Ϊ436kJ��151kJ��299kJ�����������͵ⷴӦ����1mol HI��Ҫ_____________����ų��������ա���_____________kJ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com