
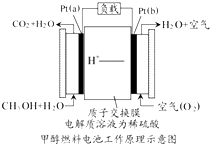
 科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:
科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:分析 (1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应;
(2)原电池反应的实质为氧化还原反应,甲醇被氧化生成二氧化碳和水;
(3)根据甲醇和转移电子之间的关系式计算.
解答 解:(1)该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,电解方程式为CH3OH+H2O-6e-═CO2+6H+,通入氧化剂的电极为正极,正极上得电子发生还原反应,电极方程式为O2+4H++4e-═2H2O,
故答案为:负;CH3OH+H2O-6e-═CO2+6H+;还原;O2+4H++4e-═2H2O;
(2)原电池反应的实质为氧化还原反应,甲醇被氧化生成二氧化碳和水,电池总反应为2CH3OH+3O2=2CO2+4H2O,
故答案为:2CH3OH+3O2=2CO2+4H2O;
(3)由电极方程式CH3OH+H2O-6e-═CO2+6H+可知,如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有$\frac{1}{3}$mol.
故答案为:$\frac{1}{3}$.
点评 本题考查了燃料电池,根据离子交换膜通过的微粒确定电解质溶液的酸碱性,再结合正负极上发生的反应来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 283:503 | B. | 55:141 | C. | 141:196 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二甲基己烷 | D. | 2,5一二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | x | C5H12O | C6H14O | … |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
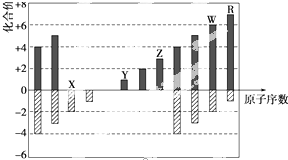
| A. | 原子半径:Z>Y>X | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | R的单质可以从W的气态氢化物的水溶液中置换出W的单质 | |
| D. | Z的最高价氧化物对应的水化物既能溶解于盐酸,又能溶解于氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com