
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是
A. Mg和Cu B. Na和Fe C. Al和Mg D. Zn和Fe
【答案】A
【解析】
如果金属全部是钠,反应生成氢气:![]() ;如果金属全部是镁,反应生成氢气:
;如果金属全部是镁,反应生成氢气:![]() ;如果金属全部是铝,反应生成氢气:
;如果金属全部是铝,反应生成氢气:![]() ;如果金属全部是锌,反应生成氢气:
;如果金属全部是锌,反应生成氢气:![]() ;如果金属全部是铁,反应生成氢气:
;如果金属全部是铁,反应生成氢气:![]() ;如果金属全部是铜,反应生成氢气体积为0L,所以A、A为镁和铜的混合物时,生成氢气介于18.67L到0L之间,可能为11.2L,选项A正确;B、A为钠和铁的混合物时,生成氢气介于9.74L到8.00L之间,不可能为11.2L,选项B错误; C、A为铝和镁的混合物时,生成氢气介于18.67L到24.89L之间,不可能为11.2L,选项C错误;D、A为锌和铁的混合物时,生成氢气介于6.89L到8.00L之间,不可能为11.2L,选项D错误;答案选A。
;如果金属全部是铜,反应生成氢气体积为0L,所以A、A为镁和铜的混合物时,生成氢气介于18.67L到0L之间,可能为11.2L,选项A正确;B、A为钠和铁的混合物时,生成氢气介于9.74L到8.00L之间,不可能为11.2L,选项B错误; C、A为铝和镁的混合物时,生成氢气介于18.67L到24.89L之间,不可能为11.2L,选项C错误;D、A为锌和铁的混合物时,生成氢气介于6.89L到8.00L之间,不可能为11.2L,选项D错误;答案选A。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. CO2、甲烷都属于温室气体
B. 用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体
C. 太阳能、风能和生物质能属于新能源
D. 太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
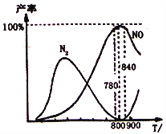
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。
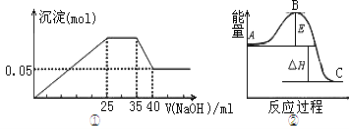
下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱核磁共振、X射线行射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______,Cr的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是______,其中S的杂化类型有_______。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______,原因是______。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____(用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线行射分析其晶胞结构如图所示。
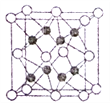
①晶胞中Na堆积形成___________(填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________。
②已知晶胞边长为anm,晶胞中Na的半径为bnm,则He的半径为_____nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把11.2 g铁加入到500 mL盐酸中,在标准状况下放出氢气的体积是3.36 L,盐酸的物质的量浓度是( )
A.0.2 mol·L-1B.0.3 mol·L-1C.0.4 mol·L-1D.0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是
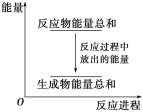
A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的化工原料F(C5H8O4)有特殊的香味,可通过如图所示的流程合成:
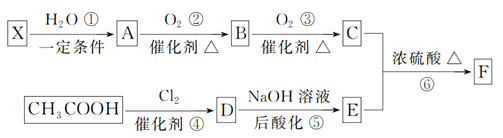
已知:①X是石油裂解气主要成分之一,与乙烯互为同系物;
②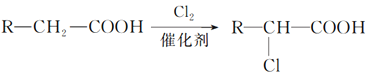 ;
;
③C、E、F均能与NaHCO3生成气体
(1)D中所含官能团的名称是_______________。
(2)反应②的化学方程式为_____________,反应类型是________;反应⑥的化学方程式为______________。
(3)F的同分异构体很多,其中一种同分异构体只含有一种官能团,在酸性或碱性条件下都能水解生成两种有机物,该同分异构体的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 非金属原子间只能形成共价键
B. 非金属原子间不可能形成离子化合物
C. 离子化合物中可能有共价键
D. 共价化合物中可能有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com