


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、单位时间内减少xmol A2,同时生成2xmol AB |
| B、单位时间内生成 2xmol AB,同时生成xmol A2 |
| C、单位时间内减少xmol B2,同时生成xmol AB |
| D、单位时间内1molA-A键断裂,同时形成2 mol A-B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
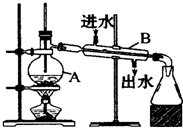 Ⅰ、可用于物质的分离与提纯的常用方法主要有:A.蒸馏B.过滤C.结晶D.升华E.萃取,分液.下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
Ⅰ、可用于物质的分离与提纯的常用方法主要有:A.蒸馏B.过滤C.结晶D.升华E.萃取,分液.下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com