
���� ��1��2min�ﵽƽ�⣬C��Ũ��Ϊ1.2mol/L�����v=$\frac{��c}{��t}$���㣻
��2��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B������B�ķ�Ӧ���ʣ���Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�
��3��2A��g��+B��g��?xC��g��+2D��s����
��ʼ 2 2 0 0
ת�� 1.6 0.8
ƽ��0.4 1.2
�Դ˼���ת����A��ת������B��ת����֮�ȣ�
��4�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��� �⣺��1��2min�ﵽƽ�⣬C��Ũ��Ϊ1.2mol/L��������C��ƽ����Ӧ����Ϊv=$\frac{1.2mol/L}{2min}$=0.6mol•��L•min��-1���ʴ�Ϊ��0.6mol•��L•min��-1��
��2��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B����B�ķ�Ӧ����Ϊ��v��B��=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol•��L•min��-1���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪����v��B����v��C��=0.2mol•��L•min��-1��0.6mol•��L•min��-1=1��x�����x=3��
�ʴ�Ϊ��3��
��3��2A��g��+B��g��?xC��g��+2D��s����
��ʼ 2 2 0 0
ת��1.6 0.8
ƽ��0.4 1.2
��A��B��ת����֮��=$\frac{1.6}{2}$��$\frac{0.8}{2}$=2��1��
�ʴ�Ϊ��2��1��
��4��2A��g��+B��g��?3C��g��+2D��s������Ӧǰ�������������
A����Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬��ѹǿʼ�ղ��仯����ѹǿ�������жϷ�Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ���������������仯�������ݻ����䣬���ܶ�Ϊ�������������ܶȲ��ٱ仯��˵����Ӧ�ﵽƽ��״̬����B��ȷ��
C����Ӧǰ�����������仯���������ʵ������䣬�������ƽ����Է�������Ϊ�������������ƽ�����������ٱ仯ʲô��Ӧ�ﵽƽ��״̬����C��ȷ��
D����Ӧ����֮�ȵ��ڻ�ѧ����ʽϵ��֮�ȣ�A��B����������֮��ʼ��Ϊ2��1����ʾ�Ķ�������Ӧ�����ж����淴Ӧ�����Ƿ���ȣ���D����
�ʴ�Ϊ��BC��
���� ���⿼���˻�ѧƽ��ļ��㣬��Ŀ�ѶȲ����漰��ѧ��Ӧ���ʵļ��㡢��ѧƽ��״̬�жϼ�ת���ʵļ����֪ʶ����ȷ��ѧƽ�⼰��Ӱ��Ϊ���ؼ�������������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��ʹ��ɫʯ����ֽ�ȱ�����ɫ | |
| B�� | ������ˮ�����ݷų�����������Cl2 | |
| C�� | ������ˮ��ֻ��Cl2��H2O���� | |
| D�� | ��ˮ������������Խ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
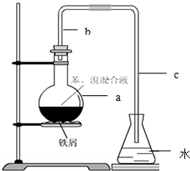
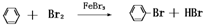 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
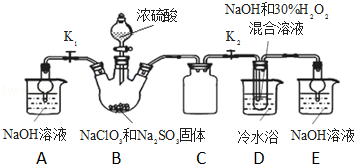
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��| ��ѧ�� | N-N | N=N | N��N | N-H | H-H |
| ����/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
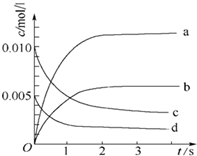 ��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��������黥Ϊͬϵ�� | |
| B�� | �����һ�ȴ���ֻ��һ�ֽṹ֤����������������ṹ����ƽ�������νṹ | |
| C�� | ���顢���顢�����еĻ�ѧ�����Ǽ��Թ��ۼ� | |
| D�� | ����������ڹ��յ������¿ɷ���ȡ����Ӧ�����ɶ����ȴ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com