
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
分析 ①碱性氧化物是和酸反应生成盐和水的氧化物,酸性氧化物是指和碱反应生成盐和水的氧化物,发生的反应都是复分解反应生成的盐为一种;
②由阴阳离子构成的化合物为离子化合物;
③电解质是指在水溶液中或熔融状态下能够导电的化合物,水溶液中能完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;非电解质是指在水溶液中和熔融状态下能够导电的化合物;
④酸指电离时所有阳离子都是氢离子的化合物;碱指电离时所有阴离子都是氢氧根离子的化合物;盐指由金属阳离子和酸根阴离子构成的化合物;两种元素组成其中一种是氧元素的化合物;
⑤NaHCO3是发酵粉主要成分之一俗称小苏打,可冶疗胃酸过多,碳酸钠碱性强不能用来治疗胃酸过多;
⑥不同物质组成的为混合物,同一种物质组成的为纯净物;
解答 解:①Na2O、Fe2O3和酸反应生成盐和水属于碱性氧化物,A12O3 和酸、碱反应生成盐和水属于两性氧化物,CO2、SO2能和碱溶液发生反应属于酸性氧化物,NO2都和碱反应生成盐和水发生的是氧化还原反应,不是酸性氧化物,故①错误;
②碳酸钠是钠离子和碳酸根离子构成,氢氧化钡是钡离子和氢氧根离子构成,氯化铵是铵根离子和氯离子构成,过氧化钠是钠离子和过氧根离子构成,都属于离子化合物,故②正确;
③蔗糖水溶液中和熔融状态都不导电的化合物属于非电解质,硝酸钾溶于水完全电离属于强电解质,硫酸钡难溶于水但熔融状态完全电离导电,属于强电解质,故③错误;
④醋酸属于酸,烧碱是氢氧化钠属于碱,纯碱是碳酸钠属于盐,生石灰为氧化钙属于氧化物,故④正确;
⑤NaHCO3俗称小苏打,是发酵粉主要成分之一,Na2CO3碱性强腐蚀性强,不能冶疗胃酸过多,应用碳酸氢钠治疗胃酸过多,故⑤错误;
⑥盐酸是氯化氢的水溶液属于混合物,而液氯、冰醋酸均是一种物质组成属于纯净物,故⑥正确;
故选D.
点评 本题考查了物质分类、物质组成的应用,难度不大,掌握物质的组成和化学概念实质是解题的关键.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-+CO32-+3H+→2CO2↑+2H2O | B. | HCO3-+3CO32-+7H+→4CO2↑+4H2O | ||
| C. | 2HCO3-+CO32-+4H+→3CO2↑+3H2O | D. | CO32-+H+→HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 9:11 | C. | 32:9 | D. | 46:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、纤维素均为高分子有机物 | |
| B. | 酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用新制Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖溶液 | |
| D. | 分子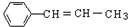 所有碳原子一定不能共平面 所有碳原子一定不能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AtI与液氨反应,是非氧化还原反应 | |
| B. | AtI与液氨反应,AtI既是氧化剂又是还原剂 | |
| C. | ZnAt2只是氧化产物 | |
| D. | ZnI2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
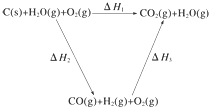 将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com