

���� �����̿�֪�����ճ�I�з���SO2+OH-=HSO3-��CO2+OH-=HCO3-��NO����Ӧ�����ճآ��У�����������NOת��ΪNO2-������NO+H2O+Ce4+=Ce3++NO2-+2H+�����ճآ���NaHSO3��Һ��HSO3-�ĵ������ˮ�⣬HSO3-?SO32-+H+����Һ��ʾ���ԣ�����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ����آ���ʹCe4+������Ceʧȥ�����������õ��������Ϸ���2HSO3-+4H++4e-=S2O32-+3H2O�������آ��еõ��ֲ�ƷNH4NO3��NO2-��ȫת��ΪNH4NO3������V��S�õ����ӣ������آ������õ����ӣ���ϵ����غ���㣮
��� �⣺�����̿�֪�����ճ�I�з���SO2+OH-=HSO3-��CO2+OH-=HCO3-��NO����Ӧ�����ճآ��У�����������NOת��ΪNO2-������NO+H2O+Ce4+=Ce3++NO2-+2H+�����ճآ���NaHSO3��Һ��HSO3-�ĵ������ˮ�⣬HSO3-?SO32-+H+����Һ��ʾ���ԣ�����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ����آ���ʹCe4+������Ceʧȥ�����������õ��������Ϸ���2HSO3-+4H++4e-=S2O32-+3H2O�������آ��еõ��ֲ�ƷNH4NO3��
��1��������������֪��Ce4+��CO2��ѭ�����ã���������CO2����Ӧ�ã��ʴ�Ϊ��Ce4+��CO2��
��2���Ҵ�����HOCH2CH2NH2������ˮ��Һ���������ԣ��Լ��Ե�ԭ��HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-���Ҵ�������CO2�Ļ�ѧ����ʽΪHOCH2CH2NH2+H2O+CO2=HOCH2CH2NH4HCO3��
�ʴ�Ϊ��HOCH2CH2NH2+H2O+CO2=HOCH2CH2NH4HCO3��
��3�����ճآ��У�����������NOת��ΪNO2-�����ӷ���ʽΪNO+H2O+Ce4+=Ce3++NO2-+2H+��
�ʴ�Ϊ��NO+H2O+Ce4+=Ce3++NO2-+2H+��
��4��NaHSO3��Һ��HSO3-�ĵ������ˮ�⣬HSO3-?SO32-+H+����Һ��ʾ���ԣ�����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ�
�ʴ�Ϊ��HSO3-����Һ�д��ڵ���ƽ�⣺HSO3-?SO32-+H+����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ�c��H+������
��5���ڵ����У���������Ce3+ʧ���ӳ�ΪCe4+�Ĺ��̣���������Ce4+�ӵ��۵������ϼ�a�����������ص����������õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ2HSO3-+4H++4e-=S2O32-+3H2O��
�ʴ�Ϊ��a��2HSO3-+4H++4e-=S2O32-+3H2O��
��6��������������ӡ���������ӵ����ʵ����ֱ���m��n���Ӣ�����������泥�����NԪ���غ㣬�õ���m+n=$\frac{x��1000}{80}$��4Ce3++2HSO3-+4H+$\frac{\underline{\;ͨ��\;}}{\;}$4Ce4++2S2O32-+3H2O����ϵ���ת�ƹ�ϵ���õ�4Ce3+��2HSO3-��2S2O32-��4Ce4+��NO��NO2-��e-��NO��NO3-��e-�����ݵ����غ㣬�õ�m+3n=n��Ce4+��=4n��S2O32-�������Եõ���m+3n=4cy��1000�������٢ڽ��m=$\frac{75x}{8}-2000c$y�����ݷ�Ӧ2NH3+2H++O2+2NO2-=2NH4NO3���õ�n��O2��=$\frac{1}{2}n��N{O_2}^-��=\frac{75x}{8}-1000cy$�����������V=22.4��$\frac{75x}{8}$-1000cy����10-3m3=0.21x-22.4cym3��
�ʴ�Ϊ��0.21x-22.4cym3��
���� ���⿼����������ᴿ�����������еķ�Ӧ���������뷽��ѡ��Ϊ���Ĺؼ������ط�����Ӧ�������ͼ��������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�ѶȽϴ�


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ��ʧ����������þ�� | B�� | ˮ�������ȶ� | ||
| C�� | �������������ǿ | D�� | �������Ʊ��������ȼ���ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | mֵΪ3 | |
| B�� | B��ת����Ϊ20% | |
| C�� | A��ƽ����Ӧ����Ϊ0.1mol•L-1•min-1 | |
| D�� | ƽ��ʱ��Ӧ����������ʵ���Ϊ1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+ | B�� | Cl- | C�� | ca2+ | D�� | S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
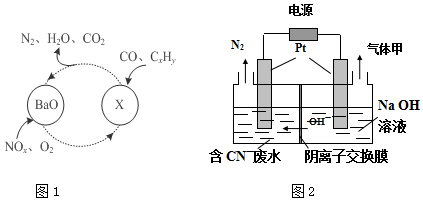
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 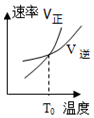 | B�� | 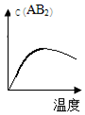 | C�� | 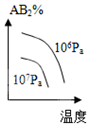 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO3��H2SO4��H2SO3 | B�� | SO2��H2SO3��H2SO4 | C�� | SO3��H2SO3��H2SO4 | D�� | SO2��H2SO4��H2SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHSˮ�ⷴӦ��HS-+H2O�TH3O++S2- | |
| B�� | 1mol��Cl2ͨ�뺬1mol FeI2����Һ�У�2Fe2++2I-+2Cl2�T2Fe3++4Cl-+I2 | |
| C�� | ̼��������Һ�м������Ba��OH��2��Һ��2HCO3-+Ba2++2OH-�TBaCO3��+CO32-+2H2O | |
| D�� | ��NaAlO2��Һ�м���̼�����ƣ�AlO2-+HCO3-+H2O�TAl��OH��3��+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
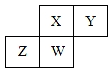 ������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ���ǣ�������
������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ���ǣ�������| A�� | ԭ�Ӱ뾶��Z��W��X��Y | |
| B�� | ����������Ӧˮ��������ԣ�X��W��Z | |
| C�� | �����̬�⻯������ȶ��ԣ�Y��X��W��Z | |
| D�� | ZY2�����ۻ���Һ̬Y3��������˷����Ӽ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com