
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理.已知:NCl3熔点为﹣40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应.实验室中可用氯气和氨气反应制取NCl3 , 反应方程式为4NH3+3C12 ![]() NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式: . 写出A装置中的试管内发生的反应的化学方程式:
(2)E中的试剂为;B中的试剂为
(3)导管G末端应连接的装置为图中的(填选项字母). 
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,另一种有强氧化性,可使有色物质褪色.写出NCl3水解的化学方程式: .
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为 .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;Ca(OH)2+2NH4Cl
Mn2++Cl2↑+2H2O;Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)饱和食盐水;碱石灰
(3)c
(4)NCl3+3H2O=NH3↑+3HClO
(5)在低于95℃条件下,水浴加热蒸馏(收集70℃)
【解析】解:(1)在酸性条件下MnO2氧化Cl﹣ , 二氧化锰被还原成+2价的锰离子,氯离子被还原成单质氯气,二氧化锰与浓盐酸加热生成氯气、氯化锰和水,离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;氢氧化钙与氯化铵加热生成氨气、氯化钙和水,所以A装置中的试管内发生的反应的化学方程式:Ca(OH)2+2NH4Cl
Mn2++Cl2↑+2H2O;氢氧化钙与氯化铵加热生成氨气、氯化钙和水,所以A装置中的试管内发生的反应的化学方程式:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;所以答案是:MnO2+4H++2Cl﹣
CaCl2+2NH3↑+2H2O;所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;Ca(OH)2+2NH4Cl
Mn2++Cl2↑+2H2O;Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;(2)浓盐酸制取的氯气中含有氯化氢和水蒸气杂质,应用饱和的食盐水除掉氯化氢,当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶;B装置用于干燥氨气,所以B中的固体干燥剂为碱石灰;
CaCl2+2NH3↑+2H2O;(2)浓盐酸制取的氯气中含有氯化氢和水蒸气杂质,应用饱和的食盐水除掉氯化氢,当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶;B装置用于干燥氨气,所以B中的固体干燥剂为碱石灰;
所以答案是:饱和食盐水;碱石灰;(3)G连接的装置既能吸收可能过量的氯气和氨气,又能防止水进入C装置,图2中的c有干燥、倒吸装置,符合要求;
所以答案是:c;(4)可使湿润的红色石蕊试纸变蓝的气体为氨气,则NCl3水解的化学方程式为:NCl3+3H2O=NH3↑+3HClO,
所以答案是:NCl3+3H2O=NH3↑+3HClO.(5)因为氯化铵在NCl3中溶解,而NCl3沸点比较低易挥发,因此应采用蒸馏的方法,但由于高于95℃时NCl3易爆炸,因此应采用水浴加热的方法,进行蒸馏,控制温度只要介于70﹣95℃之间即可,
所以答案是:在低于95℃条件下,水浴加热蒸馏(收集70℃).
【考点精析】利用氯气的实验室制法对题目进行判断即可得到答案,需要熟知实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】下列操作中,可以加快Fe与稀H2SO4反应速率的是
A. 往溶液中加入少量水
B. 往溶液中加入少量FeSO4固体
C. 往溶液中加入少量较浓H2SO4
D. 用98%的浓硫酸代替稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )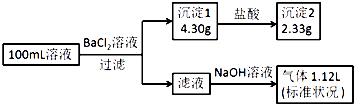
A.原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1molL﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 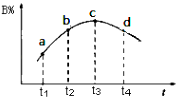
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
请回答: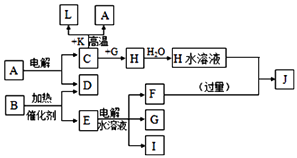
(1)写出E物质的电子式
(2)写出C与K反应的化学方程式 , 该反应的反应物总能量(填“大于”或“小于”)生成物总能量.
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 .
(4)H水溶液中离子浓度由大到小排序
(5)J与H反应的离子方程式为
(6)写出G与熟石灰反应制取漂白粉的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在一定温度和压强下,CO(g)+2H2(g)CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO,H2、CH3OH的浓度之比为1:2:1
E.CH3OH,CO,H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 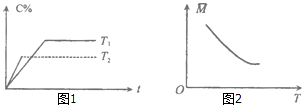
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 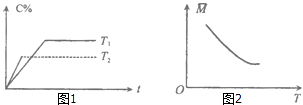
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与二氧化碳的反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com