
| A. | CH3OH | B. | CH3COOCH3 | C. | C(CH3)4 | D. | CH3COOH |
分析 核磁共振氢谱中峰值数等于有机物中氢原子的种类数.核磁共振氢谱中只给出一种峰,说明该分子中的H原子都是等效的,只有1种H原子,据此分析.
解答 解:核磁共振氢谱中只给出一种峰,说明该分子中的H原子都是等效的,只有1种H原子.
A.CH3OH中甲基中的H原子与羟基中的H原子所处化学环境不同,CH3OH有2种H原子,核磁共振氢谱中有2个峰,故A错误;
B.CH3COOCH3中的2个甲基上的H原子所处的环境不同,即含有两种H原子,故核磁共振有2个峰,故B错误;
C.C(CH3)4中的4个甲基所处的环境完全相同,即12个H原子完全等效,故核磁共振氢谱有1个峰,故C正确;
D.CH3COOH中甲基中的H原子与-COOH中的H原子所处化学环境不同,即结构中有2种H原子,核磁共振氢谱中有2个峰,故D错误.
故选C.
点评 本题考查核磁共振氢谱与有机物中氢原子的种类关系,题目难度不大,核磁共振氢谱中峰值数等于有机物中氢原子的种类数.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
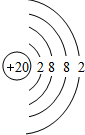 .
.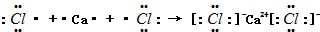 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n mol NO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
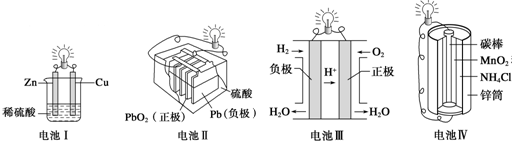
| A. | 电池Ⅰ中锌是负极 | |
| B. | 电池Ⅱ是一次电池 | |
| C. | 电池Ⅲ工作时氢气发生还原反应 | |
| D. | 电池Ⅳ工作时电子由锌通过导线流向碳棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X | B. | 最高价氧化物的水化物的酸性:R>W | ||
| C. | 气态氢化物的稳定性:X>W | D. | 单质与水(或酸)反应的剧烈程度:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
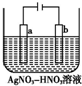 燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  +CH${\;}_{{\;}_{3}}$CH2OH→ +CH${\;}_{{\;}_{3}}$CH2OH→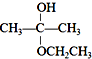 加成反应 加成反应 | |
| C. | HOCH2CH2CH2OH$\stackrel{浓硫酸}{→}$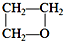 +H2O消去反应 +H2O消去反应 | |
| D. | nCH2=O$\stackrel{一定条件}{→}$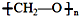 加聚反应 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
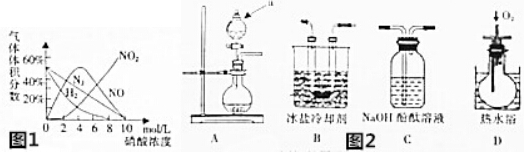
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com