
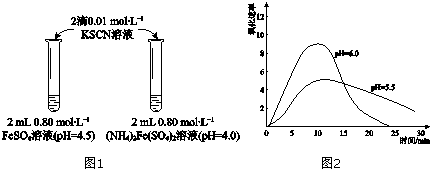
| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
分析 (1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+浓度相同,但中(NH4)2Fe(SO4)2含有浓度较高的NH4+;通过表格中的颜色变化来分析;
(2)由于是要验证两溶液的稳定性差异是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+导致,根据控制变量法可知,应除了让NH4+这个影响因素外的其它影响因素均保持一致,据此分析;
(3)由实验Ⅲ可知,溶液的pH越小,溶液的酸性越强,则Fe2+越稳定;亚铁盐溶液中存在反应4Fe2++O2+10H2O?4Fe(OH)3+8H+,根据平衡的移动来分析;
(4)根据影响反应速率的因素有浓度、压强、温度和催化剂来分析;
(5)根据上述实验来分析.
解答 解:(1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+浓度相同,但中(NH4)2Fe(SO4)2含有浓度较高的NH4+,NH4+水解显酸性,导致(NH4)2Fe(SO4)2中的pH更小;通过表格中的颜色变化可知(NH4)2Fe(SO4)2中的Fe2+被氧化的速率更慢,即溶液的稳定性:FeSO4<(NH4)2Fe(SO4)2,
故答案为:NH4++H2O?NH3•H2O+H+;<;
(2)由于是要验证两溶液的稳定性差异是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+导致,根据控制变量法可知,应除了让NH4+这个影响因素外的其它影响因素均保持一致,故应取2 mL pH=4.0的0.80 mol•L-1 FeSO4溶液于试管中,加2滴0.01 mol•L-1 KSCN溶液,过若观察到的现象与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同,则说明上述猜想不正确,
故答案为:取2 mL pH=4.0的0.80 mol•L-1 FeSO4溶液;加2滴0.01 mol•L-1 KSCN溶液;
(3)由实验Ⅲ可知,溶液的pH越小,溶液的酸性越强,则Fe2+越稳定;亚铁盐溶液中存在反应4Fe2++O2+10H2O?4Fe(OH)3+8H+,溶液的pH越小,则氢离子浓度越大,平衡左移,则Fe2+的氧化被抑制,
故答案为:溶液pH越小,Fe2+越稳定;溶液中存在平衡4Fe2++O2+10H2O?4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定;
(4)影响反应速率的因素有浓度、压强、温度和催化剂,而同一条曲线上的浓度FeSO4溶液相同,且应随着反应的进行,Fe2+的浓度减小,故不是浓度对反应速率的影响;而此反应为溶液中的反应,故压强对此反应速率无影响;而此反应中温度不变,故能影响反应速率的只有催化剂,故唯一的可能原因是生成的Fe(OH)3对反应有催化作用,故答案为:生成的Fe(OH)3对反应有催化作用;
(5)根据上述实验可知,加入一定量的酸会抑制Fe2+的氧化,或是隔绝空气密封保存,故答案为:加入一定量的酸,密封保存.
点评 本题考查了盐类的水解和探究影响Fe2+稳定性的因素,综合性较强,难度较大,应注意从影响反应速率和平衡的因素的角度来分析.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
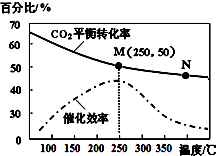 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
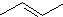 某有机物X的键线式为
某有机物X的键线式为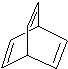 .
.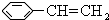 ,
, .
.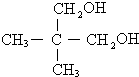 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,只伴随着热量的变化 | |
| B. | 物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生 | |
| C. | 太阳能、氢能、生物质能属于新能源 | |
| D. | 化石燃料是一次能源,乙醇是不可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com