
【题目】下列各组物质间发生的化学反应属于吸热反应的是( )
A. 木炭和氧气B. 生石灰和水C. 盐酸和氢氧化钠溶液D. NH4Cl晶体和Ba(OH)28H2O
科目:高中化学 来源: 题型:
【题目】室温下,如图为用一定物质的量浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的
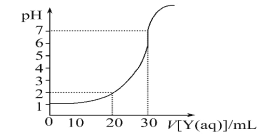
A | B | C | D | |
X/mol·L-1 | 0.12 | 0.09 | 0.04 | 0.03 |
Y/mol·L-1 | 0.04 | 0.03 | 0.12 | 0.09 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是
2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是
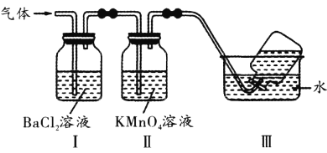
A. 反应中硫元素既体现氧化性又体现还原性
B. 装置Ⅰ中可以观察到出现白色沉淀,其主要成分是BaSO4和BaSO3
C. 装置Ⅱ中可以观察到高锰酸钾紫色褪去
D. 将装置Ⅰ、Ⅱ顺序交换,仍能观察到相同的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 干冰升华B. 酸碱中和
C. 天然气燃烧D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
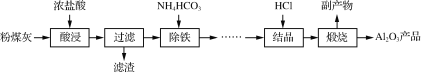
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
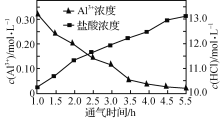
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。
(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,通入N2,压强增大,反应速率加快
C. 升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D. 该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=________。
②已知H2C2O4是二元弱酸。室温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,KHC2O4水解平衡常数的数值为____。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.770 0 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.090 0 g。
步骤Ⅱ 准确称取1.770 0 g样品,用NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.050 00 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
消耗EDTA标准溶液 的体积/mL | 25.92 | 24.99 | 25.01 |
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有____(填字母)。
A. 锥形瓶水洗后未干燥
B. 滴定时锥形瓶中有液体溅出
C. 装EDTA标准溶液的滴定管水洗后未润洗
D. 开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图
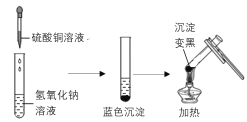
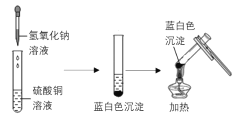
甲组 乙组
(甲组)氢氧化钠与硫酸铜反应的化学方程式为___________,加热后产生黑色的氧化铜。
(乙组)为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
(查阅资料)在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:6NaOH+4CuSO4=3Na2SO4+Cu4(OH)6SO4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
(提出猜想)根据资料分析,同学们针对试管中溶液呈酸性的原因做出了以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性 猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
(实验与结论)
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH______7(填“>”、“<”或“=”),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈______(填“酸”、“中”或“碱”)性,猜想Ⅱ不成立。
(交流与反思)(1)乙同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 _________。
(2)在化学反应中,相同的反应物因其质量比不同可能会导致生产物不同,请另举一例______(写出反应物即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com