
| A.Fe3+ | B.Fe2+ |
| C.Cu2+ | D.Fe3+、Fe2+、Cu2+ |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.92gNO2和N204混合气体中含有的原子数为3NA |
| B.标准状况下,11.2LH2O中含有的电子数为20NA |
| C.0.5mol?L“的Ba(0H)2溶液中0H一的数目为NA |
| D.1molMg与足量的02或N2反应生成MgO或Mg3N2时,失去的电子数均为2N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用浓硝酸和铁反应制取氢气 |
| B.浓硝酸是强酸,稀硝酸是弱酸 |
| C.常温下,铜和浓硝酸反应,与稀硝酸不反应 |
| D.常温下可以用,铝槽车装运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓HNO3和Cu反应,有NO2气体放出 |
| B.硝酸跟碳酸钠反应,有CO2放出 |
| C.稀HNO3和硫化亚铁反应,有H2S放出 |
| D.硝酸加热时有NO2和O2放出 |
查看答案和解析>>
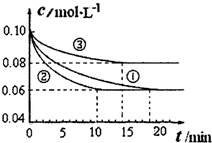
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4g | B.3.2g | C.6.4g | D.9.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

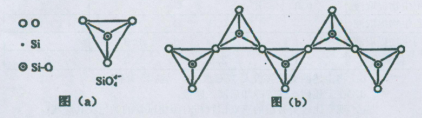
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅酸钙可用于生产黏合剂和防火剂 |
| B.用石英器皿盛放氢氟酸 |
| C.SiO2和CO2都能溶于水且与水反应生成相应的酸 |
| D.用NaHCO3治疗胃酸过多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com