
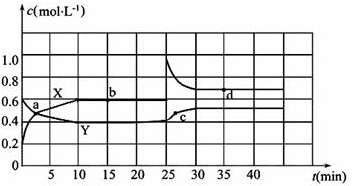
 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
分析 ①根据反应速率v=$\frac{△c}{△t}$来计算化学反应速率;
②当向容器中再加入气体,相当于增大压强,会向着气体系数和减小的方向进行;
③根据三行式计算达到平衡时各物质的浓度,进而计算化学反应的平衡常数;
④电解尿素〔CO(NH2)2〕的碱性溶液,在阳极上发生失电子的氧化反应,据此书写电极反应式.
解答 解:①70min时,平均反应速率υ (CO2 )=$\frac{\frac{0.1mol-0.02mol}{2L}}{70min}$mol/(L•min)=0.00057mol/(L•min)=5.7×10-4mol/(L•min),
故答案为:5.7×10-4mol/(L•min);
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后相当于增大压强,会向着气体系数和减小的方向进行,即向着正方向进行,所以CO2的转化率与原平衡相比将增大,故答案为:增大;
③可逆反应在70min时达到了平衡,
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(l)+H2O(g)
初始浓度:0.05 0.2 0
变化浓度:0.04 0.08 0.04
平衡浓度:0.01 0.12 0.04
所以K=$\frac{c({H}_{2}O)}{c(C{O}_{2})•{c}^{2}(N{H}_{3})}$=$\frac{0.04}{0.01×0.1{2}^{2}}$≈277.8,
故答案为:277.8;
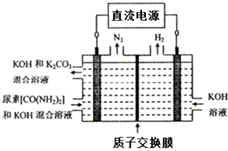
④电解尿素〔CO(NH2)2〕的碱性溶液,在阳极上发生失电子的氧化反应,电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析、计算能力的考查,题目涉及燃料电池的电极反应式、化学反应速率和平衡的有关计算等重要考点,综合性较强,难度较大.


科目:高中化学 来源: 题型:选择题

| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热晶体时先用小火,后渐改为用大火加热至晶体变白 | |
| B. | 灼烧时如有晶体溅出容器,应再加一些晶体继续加热 | |
| C. | 加热后的冷却放在干燥器中进行 | |
| D. | 加热、冷却、称量,重复多次即是恒重操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com