
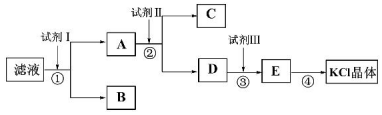
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液;为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,由实验流程可知,滤液中加试剂I为过量BaCl2,然后过滤后,B含碳酸钡、硫酸钡,A中含氯化钡、氯化钾,再加试剂Ⅱ为过量K2CO3,过滤后C中为碳酸钡,然后过滤,D中含碳酸钾、KCl,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到KCl晶体,以此来解答.
解答 解:(1)①中发生的所有反应是硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾,化学方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl,故答案为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl;
(2)②中加入试剂2的目的是除过量BaCl2,故答案为:除过量BaCl2;
(3)E含有氯化钾和盐酸,之后需要进行蒸发,蒸发的作用之一是得到KCl晶体,另一作用是:除去多余的盐酸,故答案为:除去多余的盐酸;
(4)n(AgNO3)=0.025L×0.1000mol/L=0.0025mol,发生KCl+AgNO3=AgCl+KNO 3,则n(KCl)=0.0025mol,则 100mL含有KCl0.01mol,m(KCl)=0.01mol×74.5g/mol=0.745g,质量分数为$\frac{0.745}{0.76}×100%$=98.03%.
故答案为:98.03%.
点评 本题综合考查物质的分离、提纯的实验设计,侧重于学生的分析、计算和实验能力的考查,难度不大,注意解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 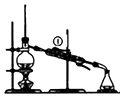 装置A可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. | 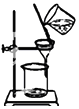 装置B可用于分离汽油和水,且汽油层由分液漏斗的下口放出 | |
| C. | 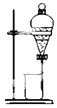 装置C可用于除去固体BaCl2中的BSaO4 | |
| D. |  装置D在配制一定物质的量浓度的溶液之前可以有水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据实验①可知溶液中不存CO32-、SiO32- | |
| B. | 该溶液中肯定存在NH4+、Fe2+ | |
| C. | 该溶液中至少含有4种离子 | |
| D. | 另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中只含NH4+、Fe2+、Fe3+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol O2 与1mol 纯碱的体积相同 | |
| B. | 常温常压下,18g H2O所含的氧原子的数目为NA | |
| C. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| D. | 1L 水溶解58.5g NaCl 所形成的溶液的物质的量浓度是0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是Z>Y>M | |
| D. | X与Z可以形成原子个数比1:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数为2NA | |
| B. | 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中,胶粒数等于0.2NA | |
| C. | 1.0g H2O与D2O的混合物所含中子数为0.5NA | |
| D. | 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com