
【题目】25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知![]() ,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是

A. 图中M、N两点对应溶液中的c(OH-)比较:前者>后者
B. 丙酸的电离常数K=10-4.88
C. 等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者
D. 将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
【答案】B
【解析】
A.M点的pH小于N点的pH值,即M点c(H+)大于N点c(H+),所以溶液中的c(OH-)应该是M点小于N点,故A错误;
B. pH=4.88时,丙酸的酸分子的物质的量分数为50%,即c(CH3CH2COOH)=c(CH3CH2COO-),针对CH3CH2COOH)![]() CH3CH2COO-+H+电离过程可知,lgK=lgc(H+)=-4.88,即丙酸的电离常数K=10-4.88,故B正确;
CH3CH2COO-+H+电离过程可知,lgK=lgc(H+)=-4.88,即丙酸的电离常数K=10-4.88,故B正确;
C.由图中信息可知,相同pH时,丙酸的酸分子的物质的量分数大,说明电离程度小,故其酸性比甲酸弱,即HCOO-的水解程度小于CH3CH2COO-的水解程度,等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较应是pH(HCOONa)<pH(CH3CH2COONa),故C错误;
D.将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,电离过程大于水解过程,所得溶液呈酸性,即c(OH-)<c(H+),D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
A. 
微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+
B. 
反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
C. 
恒温恒容条件下,发生的可逆反应2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
D. 
利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代劳动人民在生产生活中积累了丰富的经验,很多生产过程的操作方法与化学实验中的物质分离除杂方法相似。下列加有着重号的文字与对应分离方法正确的是( )
《本草集经注》 | 《通州煮海录》 | 《名医别录》 | 《续遵义府志》 |
凡渍药酒,皆须细切……便可漉出 | 海陆取卤,日晒火煎,煮海熬波,卤水成盐 | 凡煮汤,欲微火,令小沸……箅渣取液 | 经月画出蒸之……终乃得酒可饮 |
|
|
|
|
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸发、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
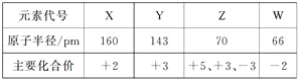
下列叙述正确的是
A. X、Y 元素的金属性X<Y
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备 NaClO2的装置如下图,其中C装置内生成ClO2下列说法正确的是

A. 实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲
B. 可用98.3%硫酸代替75%硫酸
C. H2O2是制备 NaClO2反应的还原剂
D. F中的试剂可用饱和Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是红棕色固体,B是常见的强酸,C是常见的无色液体。E、F均为无色有刺激性气味的气体,其中E能使品红溶液褪色。G可用作补血剂,I是一种白色固体,在空气中最终变成红褐色。请回答下列问题:


(1)F的电子式为_____。
(2)写出反应②的离子方程式,并用单线桥标出电子转移的方向和数目_____。
(3)可确定反应②中金属离子已完全反应的试剂为_____(填化学式)。反应③的装置如上图所示,倒置漏斗的作用是_____。
(4)写出反应③的离子方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com