


分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)氧化铁是一种红棕色的粉末,常用颜料等;
(2)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管、100mL容量瓶;
(3)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加NaClO也能将Fe2+全部氧化为Fe3+,根据元素守恒和电荷守恒书写离子方程式;
(4)补血剂中是硫酸亚铁,加入双氧水和氨水后生成硫酸铵、氢氧化铁;
(5)A.步骤c所加氨水量不足,则铁元素不能完全沉淀,则最终氧化铁的质量偏小;
B.步骤d洗涤不充分,则所得氧化铁中含有其它杂质,会导致其质量偏大;
C.步骤d灼烧不充分,会使所称得的氧化铁的质量偏大;
(6)向1L浓度均为1.0mol/L的Fe(NO3)3和Cu(NO3)2混合液中逐滴加入铁粉至过量,铁先与铁离子生成亚铁离子,此时消耗铁的物质的量为0.5mol,生成亚铁离子的物质的量为1.5mol,再与铜离子生成铜单质和亚铁离子,此时又会生成亚铁离子1mol,据此可画出图;
解答 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)氧化铁是一种红棕色的粉末,常用作颜料等,
故答案为:红棕;颜料;
(2)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管、100mL容量瓶,
故答案为:胶头滴管、100mL容量瓶;
(3)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,加NaClO也能将Fe2+全部氧化为Fe3+,根据元素守恒和电荷守恒可知离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O,
故答案为:将Fe2+全部氧化为Fe3+;ClO-+2Fe2++2H+=Cl-+2Fe3++H2O;
(4)补血剂中是硫酸亚铁,加入双氧水和氨水后生成硫酸铵、氢氧化铁,所以步骤c所得红褐色浊液中的溶质除Fe(OH)3、H2O2、氨水外还含(NH4)2SO4,
故答案为:(NH4)2SO4;
(5)A.步骤c所加氨水量不足,则铁元素不能完全沉淀,则最终氧化铁的质量偏小,会导致所测定的铁元素含量偏低;
B.步骤d洗涤不充分,则所得氧化铁中含有其它杂质,会导致其质量偏大,会导致所测定的铁元素含量偏高;
C.步骤d灼烧不充分,会使所称得的氧化铁的质量偏大,会导致所测定的铁元素含量偏高,
故选BC:
(6)向1L浓度均为1.0mol/L的Fe(NO3)3和Cu(NO3)2混合液中逐滴加入铁粉至过量,铁先与铁离子生成亚铁离子,此时消耗铁的物质的量为0.5mol,生成亚铁离子的物质的量为1.5mol,再与铜离子生成铜单质和亚铁离子,此时又会生成亚铁离子1mol,据此可画出图为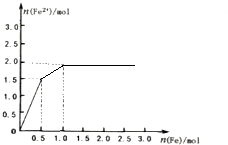 ,
,
故答案为: .
.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、根据计算画图等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 汤姆生根据α粒子散射实验提出了“葡萄干面包式”的原子结构模型 | |
| B. | 石油的裂化是为了获得乙烯、丙烯这样的短链烃 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向Al2(SO4)3溶液中加入过量NH3?H2O:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| C. | 酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+═Cl2↑+3H2O | |
| D. | 向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-═2Na++SO42-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com