
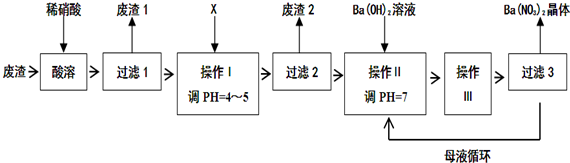
分析 废渣的主要成分为BaCO3、BaSO3、Ba(FeO2)2等,由流程可知,加硝酸溶解,生成硝酸钡、硝酸铁,硝酸与亚硫酸钡发生氧化还原反应生成硫酸钡,则废渣1为硫酸钡,X既要能中和硝酸,又不产生新杂质,结合实际,故可用BaCO3,调节pH使铁离子转化为沉淀,然后过滤,废渣2为Fe(OH)3,然后加氢氧化钡溶液调节pH为中性,结合Ba(NO3)2的溶解度受温度影响较大,则操作Ⅲ为蒸发浓缩、冷却结晶,再过滤、洗涤、干燥得到Ba(NO3)2晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器中,以此来解答.
解答 解:废渣的主要成分为BaCO3、BaSO3、Ba(FeO2)2等,由流程可知,加硝酸溶解,生成硝酸钡、硝酸铁,硝酸与亚硫酸钡发生氧化还原反应生成硫酸钡,则废渣1为硫酸钡,X既要能中和硝酸,又不产生新杂质,结合实际,故可用BaCO3,调节pH使铁离子转化为沉淀,然后过滤,废渣2为Fe(OH)3,然后加氢氧化钡溶液调节pH为中性,结合Ba(NO3)2的溶解度受温度影响较大,则操作Ⅲ为蒸发浓缩、冷却结晶,再过滤、洗涤、干燥得到Ba(NO3)2晶体,
(1)由化合物中正负化合价的倒数和为0可知,Ba(FeO2)2与中钡元素为+2价,O为-2价,则铁元素为+3价,与硝酸反应生成Ba(NO3)2和Fe(NO3)3,其反应方程式为Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:+3;Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)由上述分析可知,废渣1为BaSO4,故答案为:BaSO4;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故答案为:B;
(4)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(5)设参加反应的Ba(NO3)2为xg,则
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
261 233
x 4.66g
$\frac{261}{x}=\frac{233}{4.66g}$,解得x=5.22g,
则该Ba(NO3)2的纯度为$\frac{5.22g}{6.96g}$×100%=75%,
故答案为:75%.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握实验流程、物质的性质、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
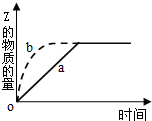 如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示可逆反应X(g)+Y(g)?Z(g)+M(g).进行过程中Z的物质的量随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 压缩反应容器的体积 | B. | 加入一定量的Z | ||
| C. | 降低温度 | D. | 减少X的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 足量铁加入少量稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H6O | C. | C2H4O | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④⑤ | C. | ①②③ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com