
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
分析 将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.则
X(g)+3Y(g)?2Z(g)
开始 1 3 0
转化 0.2 0.6 0.4
10min 0.8 2.4 0.4
结合v=$\frac{△c}{△t}$及物质的量与反应中热量变化成正比计算.
解答 解:将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.则
X(g)+3Y(g)?2Z(g)
开始 1 3 0
转化 0.2 0.6 0.4
10min 0.8 2.4 0.4
A.10min内,Y的平均反应速率为$\frac{\frac{0.6mol}{2L}}{10min}$=0.03 mol•L-1•min-1,故A正确;
B.10min内,X的平均反应速率为$\frac{\frac{0.2mol}{2L}}{10min}$=0.01 mol•L-1•min-1,不能计算即时速率,故B错误;
C.由上述分析可知,10min内,消耗0.2mol X,生成0.4 mol Z,故C错误;
D.由反应可知,1molX与3molY完全反应放出热量为akJ,则10min内,X和Y反应放出的热量为0.2a kJ,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应速率的计算公式、化学计量数与热量的关系为解答的关键,侧重分析与计算能力的考查,注意B为易错点,题目难度不大.


科目:高中化学 来源: 题型:推断题
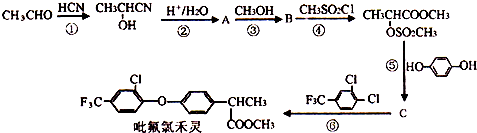
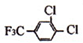 +
+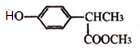 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$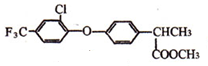 +HCl.
+HCl. .
.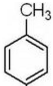 制备高分子化合物
制备高分子化合物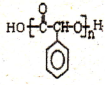 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号是零族元素 | B. | 第七周期共有32种元素 | ||
| C. | 四种元素都有放射性 | D. | 四种元素都是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
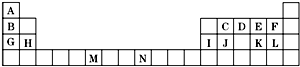 如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分是甲烷,它属于不可再生能源 | |
| B. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| C. | 石油分馏得到的汽油、煤油、柴油等都有混合物,没有固定的熔沸点 | |
| D. | 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液 | |
| B. | 除去干燥CO2中混有的少量SO2:将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 探究不同催化剂对H2O2分解速率的影响:在相同条件下,向两支试管均加入2 mL5%H2O2,然后同时分别加入少许等量MnO2固体粉末和FeCl3固体粉末,观察并比较实验现象 | |
| D. | 证明铁的金属性比铜强:常温下,分别向盛有浓硝酸的两支试管中加入铁粉和铜粉,观察并比较产生气体的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 与氧气的燃烧反应:2CH3CH2OH+O2$\stackrel{点燃}{→}$2CH3CHO+2H2O | |
| C. | 与氧气的催化氧化:CH3CH2OH+3O2$→_{△}^{Cu或Ag}$2CO2+3H2O | |
| D. | 与乙酸的酯化反应:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去氯气中的HCl气体 | |
| B. | 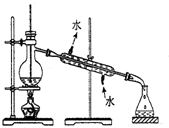 分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 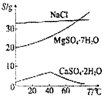 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com