
(11分)反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g) △H=bkJ·mol—1
FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g) △H=bkJ·mol—1
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
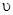 是速率、
是速率、 为混合物中CO含量,T为温度且T1>T2)
为混合物中CO含量,T为温度且T1>T2)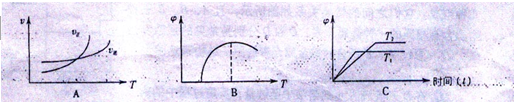
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
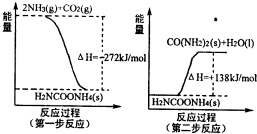
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
2- 3 |
- 3 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com